- 60.24 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学知识点之碳的多样性和硅
考试要点
1.碳族元素原子结构的特点、碳族元素化合价为正四价和正二价;
2.碳族元素的性质及其递变规律;
3.碳和硅的性质、用途。
难点聚焦
碳和硅的化学性质
化学性质
碳
硅
还原性
与单质反应
(不稳定)
与氧化物反应
与酸反应
不与、等反应,但有:
与水或碱溶液反应
与反应
二氧化碳和二氧化硅的结构、性质比较
项目
类别
酸性氧化物
酸性氧化物
晶体类型
分子晶体
原子晶体
熔点和沸点
低
高,硬度大
化学性质
不溶于水,与水也不反应
联系
3 硅及其化合物的特性
1. Si的还原性大于C,但C却能在高温下还原出Si:
2. 非金属单质跟碱液作用一般无放出,但Si却放出H2:
3. 非金属单质一般不跟非氧化性酸作用,但Si能与HF作用:
4. 非金属单质一般为非导体,但Si为半导体。
5. SiO2是的酸酐,但它不溶于水,不能直接将它与水作用制备H2SiO3。
6. 非金属氧化物的熔沸点一般较低,但SiO2的却很高。
7. 酸性氧化物一般不与酸作用,但SiO2能跟HF作用:
8. 无机酸一般易溶于水, 却难溶于水。
9. 因H2CO3的酸性大于H2SiO3,所以在Na2SiO3溶液中通入CO2能发生下列反应:,但在高温下
也能发生。
10. Na2SiO3
的水溶液称水玻璃,但它与玻璃的成分大不相同,硅酸钠水溶液(即水玻璃)俗称泡花碱,但它却是盐的溶液,并不是碱溶液。
4 硅与碱溶液的反应特点
硅与强碱溶液反应的实质是什么?究竟哪种物质是氧化剂?根据化学方程式:
进行分析,似乎和都是氧化剂,其实不然。上述反应实际分两步进行
①
②
其中反应①为氧化还原反应,反应②为非氧化还原反应。合并①②两式得总反应方程式。其中NaOH既不是氧化剂,也不是还原剂,只是反应物、起氧化作用的只是H2O。所以H2O是①式的氧化剂,也是总反应的氧化剂。为表示反应的实质(或要求标出电子转移方向和数目时),可写成:
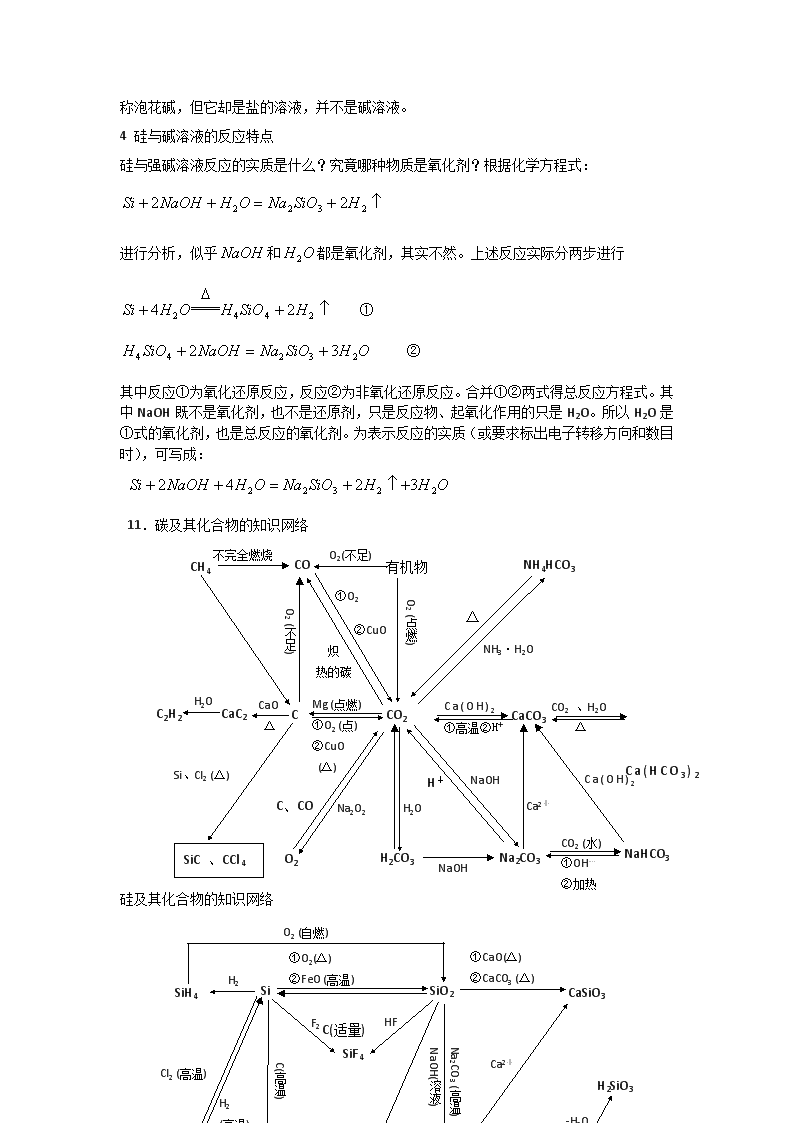
11.碳及其化合物的知识网络
C
CO2
CaCO3
CaC2
C2H2
CO
有机物
NH4HCO3
CH4
H2CO3
Na2CO3
NaHCO3
O2
SiC 、CCl4
不完全燃烧
O2(不足)
O2 (不足)
①O2
②CuO
炽
热的碳
NH3·H2O
O2 (点燃)
△
H2O
CaO
△
Si、Cl2 (△)
Mg (点燃)
①O2 (点)
②CuO
(△)
C、CO
Na2O2
NaOH
H2O
NaOH
H+
Ca(OH)2
①高温②H+
Ca2+
CO2 、H2O
△
Ca(OH)2
CO2 (水)
①OH―
②加热
Ca(HCO3)2
硅及其化合物的知识网络
Na2SiO3
CO2,H2O
NaOH
H2SiO3
SiH4
Si
SiO2
CaSiO3
SiF4
H4SiO4
SiC
SiCl4
O2 (自燃)
H2
①O2(△)
②FeO (高温)
F2
HF
Cl2 (高温)
H2
(高温)
C(高温)
C(高温)足量
Na2CO3 (高温)
NaOH(溶液)
①CaO(△)
②CaCO3 (△)
Ca2+
-H2O
C(适量)