- 167.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时分层作业(二十)
(建议用时:40分钟)
[基础达标练]
1.下列有关化学电池的说法中正确的是( )
A.化学电池只能将化学能转化为电能
B.燃料电池能将全部化学能转化为电能
C.锌银电池比能量大,电压稳定,储存时间长
D.一次电池包括干电池和蓄电池
C [蓄电池不但可以将化学能转化为电能(放电),也可以将电能转化为化学能(充电);燃料电池的能量转换率超过80%,但不可能100%转换,蓄电池可重复使用,属于二次电池。 ]
2.获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池的总方程式为2Al+3I2===2AlI3。下列说法不正确的是( )
A.该电池负极的电极反应式为Al-3e-===Al3+
B.电池工作时,溶液中铝离子向正极移动
C.消耗相同质量金属时,用锂作负极时,产生电子的物质的量比铝多
D.该电池可能是一种可充电的二次电池
D [A项,铝作原电池的负极,电极反应式为Al-3e-===Al3+,正确;B项,电池中阳离子向正极移动,正确;C项,7克锂失去1摩尔电子,27克铝失去3摩尔电子,所以等质量的金属,锂产生的电子比铝多,正确;D项,在溶液中,该反应不能逆向进行,该电池不是可逆电池(二次电池),是一次电池,错误。]
3.下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池I中锌是正极
B.电池Ⅱ是一次电池
C.电池Ⅲ工作时,氢气发生还原反应
4
D.电池Ⅳ工作时,电子由锌通过导线流向碳棒
D [电池Ⅰ中锌是负极,铜是正极,A错误;电池Ⅱ为铅蓄电池,属于二次电池,B错误;电池Ⅲ为氢氧燃料电池,H2在负极失去电子发生氧化反应,C错误;电池Ⅳ为锌锰干电池,锌为负极,碳棒为正极,电子由负极沿导线流向正极,D正确。]
4.镍镉(NiCd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2
有关该电池的说法正确的是 ( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiO(OH)+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
A [由总反应可知,放电时,负极Cd发生氧化反应:Cd-2e-+2OH-===Cd(OH)2,负极碱性减弱,C项错误;正极反应为2NiO(OH)+2e-+2H2O===2Ni(OH)2+2OH-,放电时,OH-由正极向负极移动(内电路),D项错误;充电时,电能转化为化学能,B项错误;充电时阳极发生氧化反应,即为Ni(OH)2+OH--e-===NiO(OH)+H2O,A项正确。]
5.氢氧燃料电池用于航天飞机,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2+4OH--4e-===4H2O;正极:O2+2H2O+4e-===4OH-。当得到1.8 L饮用水时,电池内转移的电子数约为( )
A.1.8 mol B.3.6 mol
C.100 mol D.200 mol
D [n(H2O)==100 mol,由总反应方程式:2H2+O2===2H2O,知每生成2 mol H2O转移电子4 mol,则得到100 mol H2O转移电子200 mol。]
6.(1)依据原电池的构成,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)===2CO(g)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
C.2H2O(l)===2H2(g)+O2(g)
D.2CO(g)+O2(g)===2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应式:______________________________________
______________________。
4
(2)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式:________________________________。
[解析] (1)自发的氧化还原反应可以设计成原电池,故选D;负极失电子发生氧化反应,负极反应式为CO-2e-+CO===2CO2。(2)氮气—氢气燃料电池中,氢气在负极放电,氮气在正极放电,溶液中铵根离子浓度逐渐增大,所以正极反应式为N2+6e-+8H+===2NH。
[答案] (1)D CO-2e-+CO===2CO2 (2)N2+6e-+8H+===2NH
[能力提升练]
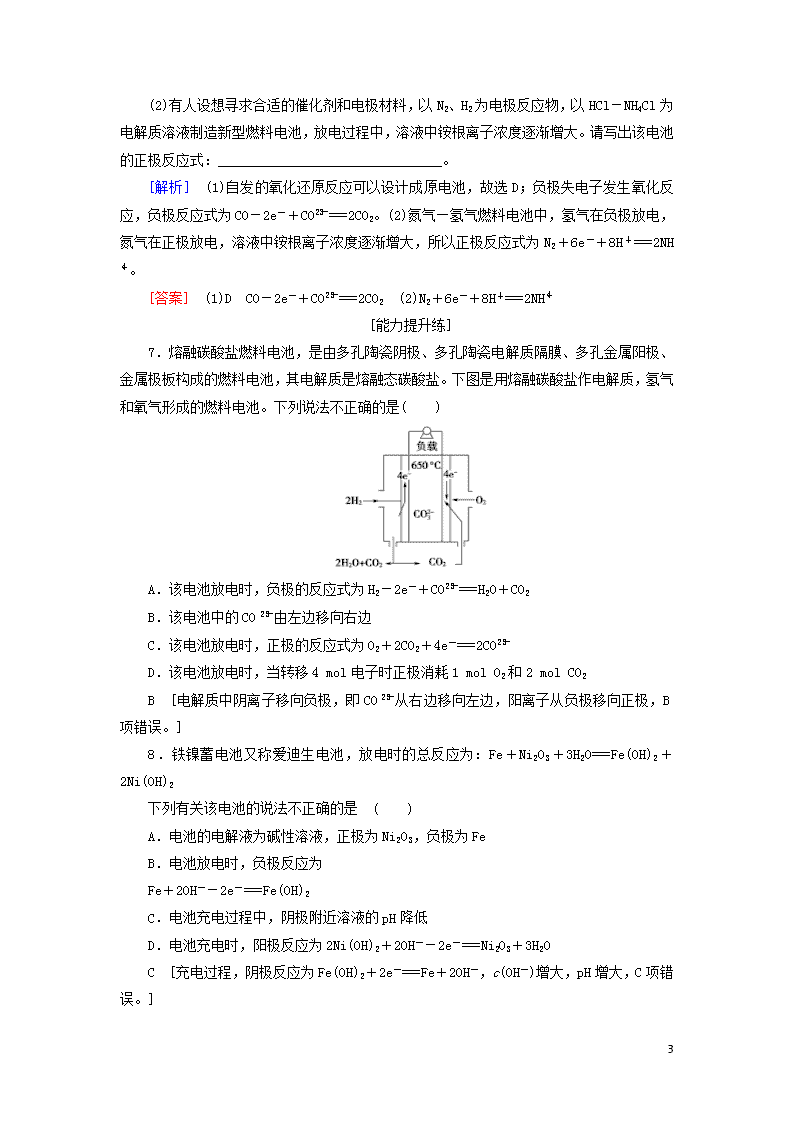
7.熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池,其电解质是熔融态碳酸盐。下图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池。下列说法不正确的是( )
A.该电池放电时,负极的反应式为H2-2e-+CO===H2O+CO2
B.该电池中的CO由左边移向右边
C.该电池放电时,正极的反应式为O2+2CO2+4e-===2CO
D.该电池放电时,当转移4 mol电子时正极消耗1 mol O2和2 mol CO2
B [电解质中阴离子移向负极,即CO从右边移向左边,阳离子从负极移向正极,B项错误。]
8.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3,负极为Fe
B.电池放电时,负极反应为
Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
C [充电过程,阴极反应为Fe(OH)2+2e-===Fe+2OH-,c(OH-)增大,pH增大,C项错误。]
4
9.我国科学家研发了一种室温下“可呼吸”的NaCO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳钠米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2Na2CO3+C。下列说法错误的是 ( )
A.放电时,ClO向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-===2CO+C
D.充电时,正极反应为Na++e-===Na
D [结合总反应式和题图可知,该电池放电时Na为负极,Ni为正极。NaCO2二次电池放电时为原电池,充电时为电解池。电池放电时,ClO向负极移动,A项正确;结合总反应可知放电时需吸收CO2,而充电时释放出CO2,B项正确;放电时,正极CO2得电子被还原生成单质C,即电极反应式为3CO2+4e-===2CO+C,C项正确;充电时阳极发生氧化反应,即C被氧化生成CO2,D项错误。]
10.LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质是LiAlCl4SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2↑。
请回答下列问题:
(1)电池的负极材料为________,发生的电极反应式为
_____________________________________________________________。
(2)电池正极发生的电极反应为___________________________________。
[答案] (1)Li Li-e-===Li+
(2)2SOCl2+4e-===4Cl-+S+SO2↑
4
相关文档
- 2020-2021学年新教材化学人教版必2021-07-026页
- 2020-2021学年化学苏教版选修4课时2021-07-027页
- 2020版高中化学课时分层作业6影响2021-07-027页
- 2020高中数学 课时分层作业16 数学2021-07-015页
- 2020高中数学 课时分层作业6 组合2021-07-014页
- 2020高中数学 课时分层作业13 抛物2021-07-015页
- 高中数学第8章函数应用课时分层作2021-07-015页
- 2020-2021学年数学新教材人教A版选2021-07-017页
- 2020高中数学第2课时 补集及综合应2021-07-013页
- 2020高中数学第1课时 并集、交集及2021-07-013页