- 442.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第 1 页 共 5 页
2019 级高一年级线上线下教学衔接监测(化学)
(考试时间:80 分钟 试卷分值:100 分)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Ca:40 Fe:56
Zn:65 Ag:108 Cu:64 Ba:137
一、选择题(1-4 每题 3 分,其余每题 4 分,共 52 分)
1. 化学与生产、生活、社会密切相关。下列叙述错误的是( )
A. 还原铁粉能用作食品抗氧化剂
B. 夜空中光柱的形成属于丁达尔效应
C. 做实验剩余的金属钠不得直接丢弃在废液缸中
D. 燃煤中加入 CaO 可减少温室气体的排放
2. 下列各有机物的命名中,正确的是( )
A. 1,
5 −
二甲苯 B. 2,2,4,4--四甲基辛烷
C. 2--甲基
− 5
--乙基己烷 D.
3 −
丁烯
3. 设
NA
为阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,
22.4L
己烯和氯气发生加成反应,消耗氯气分子数为
NAB.
1molN2
和足量的
H2
在一定条件下充分反应,转移电子为
6NAC.
0.1molC100H202
分子中共含有
30.1NA
个共价键
D. 向含有
0.4mol
的浓盐酸中加入足量的
MnO2
充分反应后可产生氯气的分子数为
NA4. 根据元素周期表判断,下列叙述不正确的是( )
A. 周期表中第七周期共有 32 种元素
B. 周期表中共有 18 个列,其中形成化合物种类最多的在第 14 列
C. 除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
D. L 层电子为奇数的所有元素所在族的序数与该元素原子的 L 层电子数相等
5. 分子式为
C7H16
的烷烃中,含有 4 个甲基的同分异构体数目是( )
A. 4 种 B. 3 种 C. 2 种 D. 5 种
6. 下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
在上述实验过程中,所涉及的三次分离操作分别是( )
A.
①
蒸馏
②
过滤
③
分液 B.
①
分液
②
蒸馏
③
蒸馏
C.
①
蒸馏
②
分液
③
分液 D.
①
分液
②
蒸馏
③
结晶、过滤
7. 四种主族元素的离子
aX
m+
、
bY
n+
、
cZ
n−
和
dR
m−
(a
、b、c、d 为元素的原子序
数
)
,它们具有相同的电子层结构,若
m > n
,则下列叙述正确的是( )
①a − b = n − m ②
元素的原子序数:
a > b > c > d
③
元素非金属性:
Z > R ④
最高价氧化物对应的水化物的碱性:
X > YA. 只有
③
B.
①②③④
C.
①②③
D.
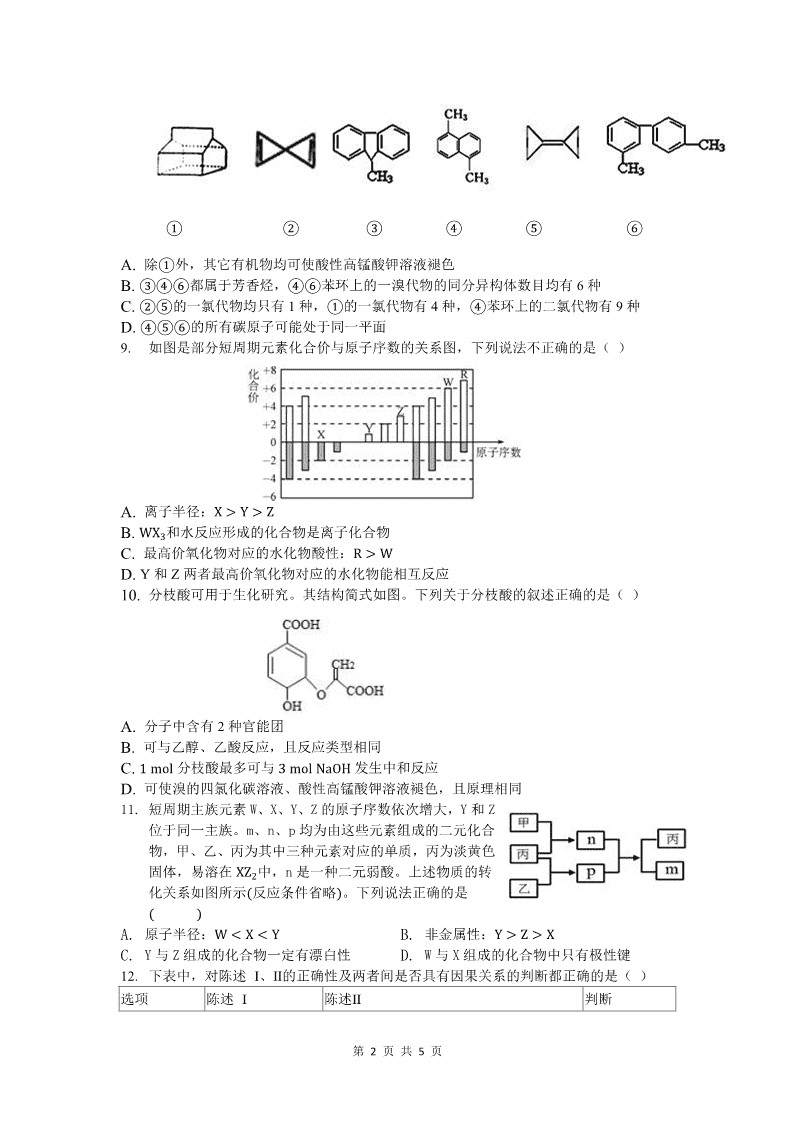
②③8. 对下列有机物的判断错误的是( )
第 2 页 共 5 页
① ② ③ ④ ⑤ ⑥A. 除
①
外,其它有机物均可使酸性高锰酸钾溶液褪色
B.
③④⑥
都属于芳香烃,
④⑥
苯环上的一溴代物的同分异构体数目均有 6 种
C.
②⑤
的一氯代物均只有 1 种,
①
的一氯代物有 4 种,
④
苯环上的二氯代物有 9 种
D.
④⑤⑥
的所有碳原子可能处于同一平面
9. 如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
A. 离子半径:
X > Y > ZB.
WX3
和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:
R > WD. Y 和 Z 两者最高价氧化物对应的水化物能相互反应
10. 分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )
A. 分子中含有 2 种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C.
1 mol
分枝酸最多可与
3 mol NaOH
发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
11. 短周期主族元素 W、X、Y、Z 的原子序数依次增大,Y 和 Z
位于同一主族。m、n、p 均为由这些元素组成的二元化合
物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色
固体,易溶在
XZ2
中,n 是一种二元弱酸。上述物质的转
化关系如图所示
(
反应条件省略
)
。下列说法正确的是
( )A. 原子半径:
W < X < Y
B. 非金属性:
Y > Z > XC. Y 与 Z 组成的化合物一定有漂白性 D. W 与 X 组成的化合物中只有极性键
12. 下表中,对陈述 I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 陈述 I 陈述Ⅱ 判断
第 3 页 共 5 页
A KSCN 溶液可检验
Fe
3+
待测液先后滴入足量氯水和几滴 KSCN 溶
液后变为血红色,证明待测液含
Fe
3+
I 对; Ⅱ对;无
B
SO2
具有还原性
SO2
通入
Ba(NO3)2
溶液中可见白色沉淀生
成 I 对; Ⅱ对;有
C
NO2
和溴蒸气都呈
红棕色 用水可鉴别
NO2
和溴蒸气 I 对; Ⅱ错;无
D
反应物比例不同可
导致产物不同
Na 与
O2
反应可能生成 Na,也可能生成
Na2O2
I 对; Ⅱ对;有
13. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和
NO2
、
N2O4
、NO 的混合气体,这些气
体与
1.68L O2(
标准状况
)
混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸
铜溶液中加入
5mol � L
−1
NaOH 溶液至
Cu
2+
恰好完全沉淀,则消耗 NaOH 溶液的体积是( )
A. 60 mL B. 45 mL C. 30 mL D. 15 mL
14.有机物 X、Y 分子式不同,它们只含有 C、H、O 元素中的两种或三种。实验表明:将 X
和 Y 不论以任何体积比例混合,只要其物质的量之和不变,完全燃烧时消耗氧气的质量和
生成水的质量均不变。则 X、Y 可能是( )
A.
C2H4
、
C2H6O
B.
C2H2
、
C6H6C.
CH2O
、
C3H6O2
D.
CH4
、
C2H4O2二、简答题(共 4 题,48 分)
15.Ⅰ.下列各物质中,
(1)互为同位素的是__________,
(2)互为同系物的是_______,
(3)互为同分异构体的是________。
A.金刚石与石墨 B.12C 与 l4C C.CH2=CH2 与 (环丙烷) D. 与
E. 与 F.2-甲基丁烷与新戊烷 G.C3H8 和 C8H18
Ⅱ已知:A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成化合物 E,
其合成路线如图所示。回答下列问题:
(1)写出 A 物质的官能团名称:____________________。
(2)反应④的化学方程式为_______________________________,反应类型:________。
(3)某学习小组设计物质 B 催化氧化的实验装置如下,根据图 2 装置回答问题。
第 4 页 共 5 页
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KCl C.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为
_______________________________。
16.A~F 六种元素中,除 F 外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 原子结构或性质
A 其形成的一种同位素原子在考古中可推测化石的年代
B 与 A 同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性
C 地壳中含量最多的元素
D D 原子的内层电子数是最外层电子数的 5 倍
E 其单质主要存在于火山口附近
F 生活中常见的银白色金属,它有两种常见的氯化物,且相对分子质量相差 35.5
(1)F 在元素周期表中的位置是__________;A 与 C 形成的化合物 AC2 的电子式是
__________。
(2)下列事实能证明 C 和 E 的非金属性强弱的是________(填序号)。
①常温下,C 的单质呈气态,E 的单质呈固态
②C 的最简单气态氢化物的稳定性强于 E 的最简单气态氢化物的稳定性
③C 与 E 形成的化合物中,E 呈正价 ④E 的氢化物的沸点高于 C 的氢化物的沸点
(3)由 A、B、C 和氢元素四种元素所形成的阴、阳离子数目之比为 1∶1 的离子化合物是
________(填化学式),它与足量 NaOH 溶液在加热时反应的离子方程式为________________
17.Ⅰ.某工厂的工业废水中含有大量的FeSO4 和较多的Fe3+和Cu2+。为了减少污染并变废为宝,
工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
(1)检验此废水中的 Fe2+,实验室中可以选用的试剂是________。
(2)写出加入过量物质 1 后,发生的所有反应的离子方程式___________________________。
(3)操作 3 指的是__________
Ⅱ.工业上冶炼铝的原料是铝土矿( 主要成分是 Al2O3,杂质为 Fe2O3、FeO、SiO2 等)。某研究
小组设计的提纯 Al2O3 的方案如下:
第 5 页 共 5 页
(1)加盐酸后过滤得到的滤渣的主要成分是________(填化学式)。
(2)加入过量 NaOH 溶液过滤后,若滤渣中 Fe(OH)2 也被氧化,写出其被氧化的化学方程式
______________。
(3)滤液 2 中加入过量盐酸能否得到沉淀 A,请说明理由 _________________________。
18.某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回
答下列问题:
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器 b 的名称为________;
实验过程中,装置 B 中观察到的现象是______________________________;
(2)装置 A 中还会产生 CO2 气体,请写出产生 CO2 的化学方程式:____________________
____________________________________________________。
(3)装置 C 中有白色沉淀生成,甲同学认为白色沉淀含碳酸钡和硫酸钡,乙同学认为不含碳
酸钡,只有硫酸钡。
你同意谁的观点,并说明理由:
___________________________________________________
请写出生成硫酸钡,发生的离子反应方程式:
___________________________________________________
相关文档
- 2018-2019学年安徽省合肥市第六中2021-07-028页
- 【化学】安徽省合肥市第六中学20192021-07-0216页
- 【数学】安徽省合肥市第六中学20192021-07-0112页
- 安徽省合肥市第六中学2019-2020学2021-06-3012页
- 安徽省合肥市第六中学2020届高三最2021-06-238页
- 安徽省合肥市第六中学2019-2020学2021-06-192页
- 安徽省合肥市第六中学2019-2020学2021-06-169页
- 2018-2019学年安徽省合肥市第六中2021-06-1217页
- 2018-2019学年安徽省合肥市第六中2021-06-1113页
- 安徽省合肥市第六中学2020届高三最2021-06-116页