- 1.46 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
4
节
金属材料与金属矿物利用
考纲点击:
1.
了解常见金属的活动顺序。
2.
了解合金的概念
及其重要应用。
回归教材
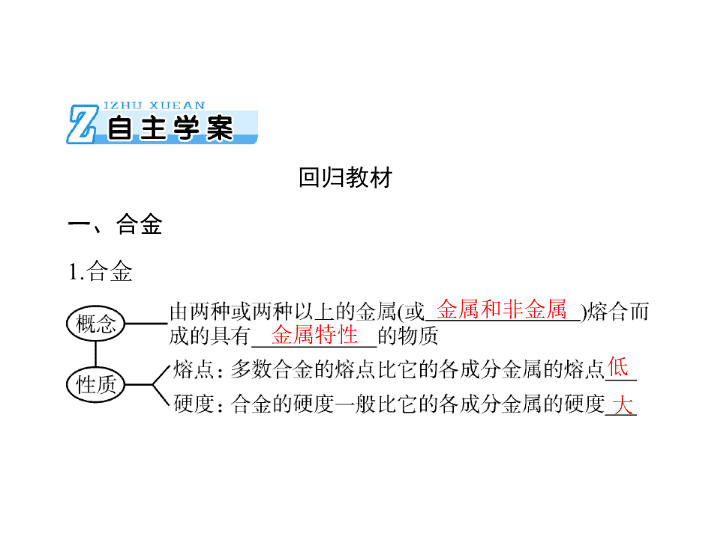
一、合金
1.
合金
金属和非金属
金属特性
低
大
铁、锰、铬
2.
常见金属材料
(1)
钢铁
正
二、金属矿物的开发和利用
1.
金属在自然界中的存在
2.
金属冶炼的一般步骤
3.
金属冶炼方法
(
用化学方程式表示
)
实验
装置
实验
现象
①
镁带剧烈燃烧,放出大量的热,并发出耀眼的白光,氧化
铁和铝粉在较高温度下发生剧烈的反应;
②纸漏斗的下部被烧穿,有熔融物落入沙中
实验
结论
高温下,铝与氧化铁发生反应,放出大量的热,反应的化学
方程式为
2Al
+
Fe
2
O
3
Al
2
O
3
+
2Fe
原理
应用
①
制取熔点较高、活泼性弱于
Al
的金属铬、锰、钨等;
②金属
焊接,如野外焊接钢轨等
4.
铝热反应
[
特别提醒
]
(1)
铝热反应是在高温干态下进行的置换反应,
铝只能与排在金属活动性顺序中铝后的金属的氧化物反应。
(2)
铝热反应是放热反应,反应引发后不需要持续加热。
(3)
铝热剂是铝粉和金属氧化物的混合物。
(4)
利用铝热反应可以冶炼高熔点金属,例如钨的冶炼。
基础测评
1.
判断正误,正确
的打
“
√
”
,错误的打
“
×
”
。
(1)
合金的成分都是金属,属于混合物
(
(2)
任何不同的金属都可熔合为合金
(
)
。
)
。
(3)
钢和生铁的熔点都比纯铁低
(
)
。
(4)
常见的铜合金有青铜、黄铜和白铜
(
)
。
(5)
合金的化学性质一般与其各成分金属的化学性质不同
(
)
。
答案:
(1)×
(2)×
(3)√
(4)√
(5)×
2.2015
年
6
月
24
日中国载人潜水器“蛟龙”号在西太平洋
的马里亚纳海沟试验海域成功创造了载人深潜的新纪录,首次
突破
7000
米,最深达到
7020
米海底。“蛟龙”号载人潜水器
的外壳是耐超高压的钛合金,下列有关合金的说法中正确的是
(
)
。
A.
钛合金
是一种新型的金属单质
B.
钛合金的熔点比成分金属的低,硬
度小
C.
钛合金的化学性质与钛单质相同
D.
青铜、碳素钢、合金钢和硬铝均是合
金
答案:
D
解析:
Al
的活动性比
H
2
强,不能用
H
2
还原法进行冶炼,
而应用电解法进行冶炼。
答案:
B
4.(2018
年重庆模拟
)
下列制备物质的工业生产流程
合理的
是
(
)
。
解析:
A
项,铝土矿的主要成分虽然是氧化铝,但含有很
多的杂质,不能直接电解,错误;
B
项,硫酸的制取过程是燃
烧硫铁矿获得
SO
2
后,用氧气在催化剂存在条件下将
SO
2
氧化
为
SO
3
,再用
98.3%
的浓硫酸吸收
SO
3
,用水吸收
SO
2
后氧化亚
硫酸的工艺相对困难,不合理;
C
项,可以用石灰乳吸收氯碱
工业产生的氯气获得漂白粉,正确;
D
项,工业上用氮气、氢
气合成氨气,加热铵盐和碱的混合物的方法适合实验室制取少
量氨气,工业上不可行,
错误。
答案:
C
5.
用铝热反应还原下列物质,制得金属各
1 mol
时,消耗铝
)
。
最少的是
(
A.MnO
2
C.V
2
O
5
B.Cr
2
O
3
D.Fe
3
O
4
解析:
制得
1 mol
金属转移电子最少的则消耗铝最少。
A
~
D
项制得
1 mol
金属转移电子的物质的量依次为
4 mol
、
3 mol
、
5 mol
、
8
3
mol
。
答案:
D
关键材料。下列有关高温合金的说法错误的是
(
考点一
考向
1
合金和常见的金属材料及其防护
合金和常见的金属材料
[
典例
1
]
高温合金是一种能够在
600 ℃
以上及一定应力条
件下长期工作
的金属材料,是涡轮发动机热端部件不可替代的
)
。
A.
高温合金可能由多种金属
(
或金属与非金属
)
组成
B.
高温合金耐腐蚀、耐高温,具有金
属特性
C.
高温合金的熔点比其成分金属熔点更高
D.
高温合金硬度大、密度小,适合制造发动机
答案:
C
. .
[
方法技巧
]
(1)
构成合金的
成分不一定是两种或两种以上的
金属,也可以是金属与非金属。合金中一定含金属元素。合金
一定是混合物。
(2)
常温下,多数合金是固态,但钾钠合金呈液态。
(3)
合金的性质不是各成分金属的性质之和。合金具有许多
良好的物理、化学和机械性能,在许多方面不同于各成分金属,
不是简单加和;但在化学性质上,一般认为合金体现的是各成
分金属的化学性质。
考向
2
金属材料的防护
的是
(
)
。
A.
在如图所示环境中,铁被腐蚀速率:
Ⅰ
>
Ⅲ
>
Ⅱ
B.
军事演习期间给坦克的履带上刷上油漆以防止生锈
C.
在海轮的外壳上常焊有锌块,且定期更新
D.
将不锈钢制成刀具和餐具,有的刀具还进行烤
蓝处理
解析:
A
项
Ⅰ
中铁做原电池负极腐蚀速率加快,
Ⅱ
中铁做
原电池正极被保护,腐蚀速率减慢,所以铁被腐蚀速率:
Ⅰ>Ⅲ>Ⅱ
;
B
项军事演习期间给坦克的履带上刷上油漆,油漆
会很快脱落起不到保护作用,错误;
C
项锌做负极保护海轮,
正确;
D
项保护措施正确。
答案:
B
金材料。下列关于铝锂合金的认识不正确的是
(
)
。
【
拓展演练
】
1.2018
年
12
月
28
日,第三架国产大型客机
C919
在上海
浦东国际机场实现首飞。
C919
机身部分采用第三代新型铝锂合
A.
铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低
于锂单质
B.
改变原料的配比,可以制得性能不同的铝锂合金
C.
铝锂合金具有金属光泽,可导电导热
D.
铝锂合金的性质与各成分金属的性质完全相同
答案:
D
. . .
2.
为防止碳素钢菜刀生锈,在使用后特别是切过咸菜后,
应将其
(
)
。
A.
洗净、擦干
B.
浸泡在水中
C.
浸泡在食醋中
D.
直接置于空气中
解析:
切过咸菜的菜刀含有电解质,如果不洗干净擦干很
容易形成原电池,原电池会加快菜刀的腐蚀。
答案:
A
考点二
考向
1
金属矿物的开发和利用
金属冶炼方法的选择
[
典例
3
](2018
年安徽芜湖质检
)
下列说法正确的是
(
)
。
A.
工业上通过电解氯化钠溶液制备金属钠和氯气
B.
钢铁厂用热还原法冶炼铁
C.
工业上电解熔融状态的
Al
2
O
3
制备
Al
不涉及氧化还原反
应
解析:
电解
NaCl
溶液生成
NaOH
、
H
2
和
Cl
2
,得不到单质
钠,
A
错误;电解熔融
Al
2
O
3
发生的是氧化还原反应,
C
错误;
工业上冶炼镁是电解熔融
MgCl
2
而不是
MgO
,
D
错误。
答案:
B
[
方法技巧
]
根据金属活
动性判断金属冶炼方法
考向
2
铝热反应
[
典例
4
](2018
年山东滨州检测
)
利用下图做铝热反应实验,
2Fe
+
Al
2
O
3
A.
该反应的化学方程式是
2Al
+
Fe
2
O
3
B.
该反应会产生高温,发出强光
C.
根据铝热反应的原理,可以冶炼某些金属
D.
若反应中转移
3 mol
电子,消耗氧化剂的物质的量是
1
mol
解析:
D
项,铁元素的化合价从+
3
价降低到
0
价,因此
1
mol Fe
2
O
3
在反应中得到
6 mol
电子,若反应中转移
3 mol
电子,
则消耗氧化剂的物质的量是
0.5 mol
,
D
错误。
答案:
D
产部分材料的流程示意图如下。下列说法不正确的是
(
【
拓展演练
】
3.(2018
届甘肃兰州一中三模
)
工业上利用无机矿物资源生
)
。
. . .
A.
在铝土矿制备较高纯度
Al
的过程中常用到
NaOH
溶液、
CO
2
气体
、冰晶石
B.
石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C.
在制粗硅时,被氧化的物质与被还原的物质的物质的量
之比为
2∶1
D.
黄铜矿
(CuFeS
2
)
与
O
2
反应产生的
Cu
2
S
、
FeO
均是还原产
物
解析:
A
项,用铝土矿制备较高纯度
Al
,首先用
NaOH
溶
液将铝土矿中的氧化铝溶解转化为偏铝酸钠溶液,然后过滤、向
滤液中通入
CO
2
气体把偏铝酸钠转化为氢氧化铝沉淀,再过滤得
氢氧化铝,接着加热氢氧化铝让其分解
为氧化铝,最后用冰晶石
作助熔剂,电解熔融的氧化铝得到铝,
A
正确;
B
项,石英的主
要成分是二氧化硅,它属于酸性氧化物,不与盐酸反应,玻璃的
主要成分有二氧化硅、硅酸钠、硅酸钙,组成中有盐,故被称为
硅酸盐产品,它也
不能与盐酸反应,实验室经常用玻璃瓶盛放盐
酸,
B
不正确;
C
项,在制粗硅时,发生反应
SiO
2
+
2C
Si
+
2CO
,被氧化的物质
C
与被还原的物质
SiO
2
的物质的量之比
为
2∶1
,
C
正确;
D
项,黄铜矿
(CuFeS
2
)
与
O
2
反应,铜由+
2
价
降为+
1
价被还原得到
Cu
2
S
、氧由
0
价降至-
2
价得到
FeO
,所
以
Cu
2
S
、
FeO
均是还原产物,
D
正确。
答案:
B
4.(2018
年山东北镇中学一模
)
为了确定一批合金废料的成
分并加以回收利用,某同学拟定了以下实验方案:
(
已知
Si
+
2NaOH
+
H
2
O===Na
2
SiO
3
+
2H
2
↑)
请回答下列问题:
(1)
从上述信息可确定该合金中一定含有
Fe
和
_________
(
填化学式
)
。
(2)“
试剂
a”
是一种不引入
杂质的绿色氧化剂,该氧化剂
的化学式为
________
;滤渣
D
与稀硫酸和试剂
a
总反应的化学
方程式为
____________________________________
。
(3)
若反应①产生的气体是
H
2
,则验证滤液
A
只含
NaAlO
2
不含
Na
2
SiO
3
的方法是取少量滤液
A
于试管中,
____________
____________________________________________________
;
如果滤液
A
只含
NaAlO
2
而不含
Na
2
SiO
3
,则反应①的离子
方程式为
_______________________________________
。
解析:
(3)
如果含有
Na
2
SiO
3
,则
Na
2
SiO
3
与酸反应生成
H
2
SiO
3
沉淀,此沉淀不与过量的酸反应,所以最终白色沉淀不
消失。
答案:
(1)Cu
(2)H
2
O
2
Cu
+
H
2
O
2
+
H
2
SO
4
===CuSO
4
+
2H
2
O
(3)
逐滴滴加稀盐酸
(
或稀硫酸
)
至过量,先产生白色沉淀,
然后沉淀完全溶解
定量测定合金组成的两种方法
1.
定量集气法
定量集气法是指收集合金中某种物质溶于酸或碱溶液时所
产生的气体的量,应用化学方程式或关系式来判断合金的组成。
其原理的关键点是某组分具有特殊性质
(
特别是与酸或碱反应
能产生气体
)
。其操作要点和注意事项有保证装置的气密性良
好,注意收集气体的读数方法。
2.
沉淀法
沉淀法测定物质含量是常用的一种方法,采用沉淀法时涉
及的基本实验操作和主要问题有称量、溶解
(
溶解试剂
)
、沉淀
(
重
点是沉淀试剂的选择
)
、过滤、沉淀洗涤、沉淀的干燥、称量及
数据的处理
(
包括测定结果的误差分析
)
。
[
典例
]
(2018
年山东济南一模
)
有三种镁铝合金样品
A
、
B
、
C(
组分比例不一定相同
)
。三位同学各取一种样品,对合金
中镁
的质量分数进行下列实验探究:
(1)
第一位同学取样品
A
m
1
g
和过量的氢氧化钠溶液反应,
然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀
过滤、洗涤、烘干、灼烧,得到固体质量仍为
m
1
g
。则合金中
镁的质量分数为
__________(
小数点后保留
2
位
)
。
(2)
第二位同学取样品
B
m
2
g
和足量的稀硫酸反应,发现固
体完全溶解,标准状况下得到气体的体积为
V
L
,则
m
2
的取值
范围是
__________(
结果化为最简分数
)
。
实验序号
a
b
c
合金质量
/g
0.51
0.765
0.918
气体体积
/mL
560
672
672
(3)
第三位同学取不同质量的样品
C
分别和
30 mL
同浓度的
盐酸反应,所取合金质量与产生气体
的体积
(
标准状况下测定
)
如表所示:
Ⅰ.
盐酸的物质的量浓度为
__________
。
Ⅱ.
合金中镁的质量分数为
__________
。
Ⅲ.
要使
c
组实验后剩
余合金中的铝恰好完全溶解,还需向
容器中加入
1.0 mol·L
-
1
的氢氧化钠溶液
______ mL
。
(3)Ⅰ.2.0 mol·L
答案:
(1)47.06%
45
V
(2) <
m
2
<
56
15
V
14
-
1
Ⅱ.47.06% Ⅲ.78
[
演练
]
(2018
年山东潍坊
)
某同学设计了如下实验测量
m
g
铜银合金样品中铜的质量分数:
A.
合金的熔点比其成分金属低,通常比成分金属具有更优
良的金属特性
B.
铜银都能与稀硝酸反应,收集到的
V
L
气体一定全为
NO
C.
操作
Ⅰ
是过滤,操作
Ⅱ
是洗涤,操作
Ⅲ
是烘干
D.
根据反应收集到的气体体积可以计算铜和银的质量分数
解析:
合金的硬度大,熔点低,
A
正确;由流程图可知,
气体用排水法
收集,二氧化氮能与水反应生成
NO
,无论金属
与硝酸反应生成的是
NO
或
NO
2
或
NO
、
NO
2
,最后收集的气体
都为
NO
,
B
正确;反应生成氯化银沉淀,过滤、洗涤、干燥,
最后得到干燥的
AgCl
固体,
C
正确;硝酸的浓度未知,无法计
算铜和银的质量分数,
D
错误。
答案:
D
相关文档
- 云南省曲靖市宣威民族中学2018-2012021-07-056页
- 化学卷·2018届四川省成都外国语学2021-07-0530页
- 辽宁省沈阳市第一七O中学2019-20202021-07-059页
- 2020届全国I卷高考考前适应性试卷 2021-07-057页
- 凤阳县皖新中学2018—2019学年度上2021-07-056页
- 2020届全国I卷高考化学考前适应性2021-07-057页
- 甘肃省张掖市第二中学2019-2020学2021-07-057页
- 辽宁省海州市高级中学2018-2019学2021-07-056页
- 河北省2020届高三化学全国1卷模拟2021-07-0515页
- 广西省桂梧高中2019-2020学年高一2021-07-054页