- 668.49 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 盐类水解原理
一、盐类水解原理
考点
清单
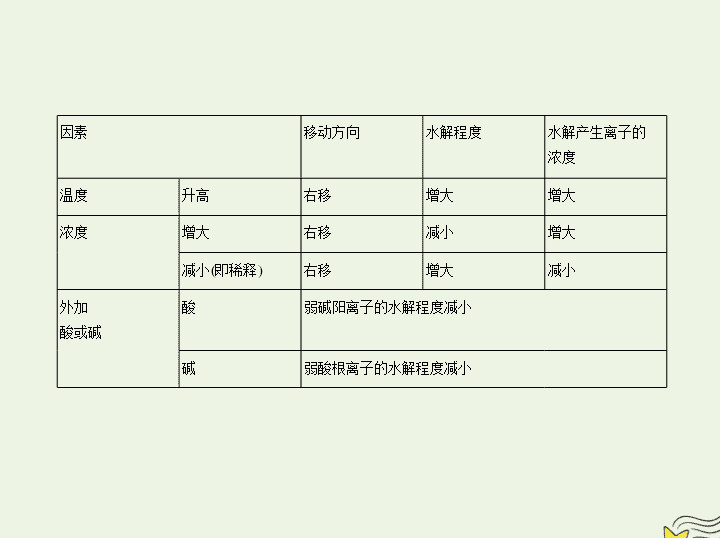
二、盐类水解的影响因素
1.内因:盐本身的性质
(1)盐对应的碱的碱性越弱,其阳离子的水解程度就越⑩
大
,对应盐溶
液的酸性越
强
。
(2)盐对应的酸的酸性越弱,其阴离子的水解程度就越
大
,对应盐溶
液的碱性越
强
。
2.外因:
因素
移动方向
水解程度
水解产生离子的
浓度
温度
升高
右移
增大
增大
浓度
增大
右移
减小
增大
减小(即稀释)
右移
增大
减小
外加
酸或碱
酸
弱碱阳离子的水解程度减小
碱
弱酸根离子的水解程度减小
三、盐类水解的规律
有弱才水解,无弱不水解;谁弱谁水解,谁强显谁性,同强显中性;越弱越水
解,越热越水解,越稀越水解。
1.组成盐的弱碱阳离子(M
x
+
)水解使溶液显
酸
性;组成盐的弱酸阴离
子(A
y
-
)水解使溶液显
碱
性。
2.盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)
越强
。
3.多元弱酸根的酸根离子比酸式酸根离子水解程度大得多,如同浓度时C
比HC
的水解程度大,含C
溶液的碱性更强。
四、酸式盐溶液酸碱性的判断
酸式盐的水溶液显什么性,要看该盐的组成粒子的实际表现。
1.强酸的酸式盐只电离,不水解,其溶液一定显酸性。如NaHSO
4
溶液:NaH-
SO
4
Na
+
+H
+
+S
。
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程
度的相对大小。
(1)若电离程度小于水解程度,则溶液显碱性。例如NaHCO
3
溶液中HC
H
+
+C
(次要)、HC
+H
2
O
H
2
CO
3
+OH
-
(主要),使溶液中
c
(OH
-
)>
c
(H
+
),溶液呈碱性;NaHS溶液、Na
2
HPO
4
溶液亦显碱性。
(2)若电离程度大于水解程度,则溶液显酸性。例如NaHSO
3
溶液中HS
H
+
+S
(主要)、HS
+H
2
O
H
2
SO
3
+OH
-
(次要),使溶液中
c
(H
+
)>
c
(OH
-
),溶液显酸性;NaH
2
PO
4
溶液亦显酸性。
五、水解方程式的书写
1.一般来说,盐类水解的程度不大,应该用可逆号“
”表示。盐类水解
一般不会产生沉淀和气体,所以一般不用符号“↓”和“↑”。如Cu
2+
水
解:Cu
2+
+2H
2
O
Cu(OH)
2
+2H
+
;N
水解:N
+H
2
O
NH
3
·H
2
O+H
+
。
2.多元弱酸盐的水解是分步进行的,用分步水解离子方程式表示。如Na
2
CO
3
的水解反应为C
+H
2
O
HC
+OH
-
、HC
+H
2
O
H
2
CO
3
+
OH
-
。
3.相互促进的水解反应方程式的书写步骤
(1)先写出水解的离子及水解后的最终产物,用“
”连接并注明“↓”
或“↑”。
(2)运用电荷守恒、原子守恒等将其配平。
如:Fe
3+
+3HC
Fe(OH)
3
↓+3CO
2
↑;2Al
3+
+3S
2-
+6H
2
O
2Al(OH)
3
↓+
3H
2
S↑
考点二 难溶电解质的溶解平衡
基础知识
一、溶解平衡
1.难溶电解质的溶解平衡
溶质溶解的过程是一个可逆过程:固体溶质
溶液中的溶质
难溶电解质的溶解平衡的特点:逆、等、动、定、变
(平衡移动原理)。
2.难溶电解质的溶解平衡的影响因素
(1)内因:难溶物质本身的性质是主要决定因素。
(2)外因:
①浓度:加水稀释,平衡向溶解方向移动,但
K
sp
不变。
②温度:升温时,多数平衡向沉淀溶解的方向移动,少数平衡向沉淀生成的
方向移动,如Ca(OH)
2
的溶解平衡,升高温度,平衡向析出Ca(OH)
2
的方向移
动,即溶解度减小。
③同离子效应:向平衡体系中加入难溶物质溶解时产生的离子,平衡逆向移
动。
④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶的物质或
更难电离的物质或气体的离子时,平衡向溶解方向移动。
二、溶度积
1.溶度积常数:一定温度下难溶电解质的饱和溶液中,各组分离子浓度幂的
乘积为一常数。
2.表达式:对于溶解平衡M
m
A
n
(s)
m
M
n
+
(aq)+
n
A
m
-
(aq)
K
sp
=[
c
(M
n
+
)]
m
·[
c
(A
m
-
)]
n
3.意义:溶度积(
K
sp
)反映了物质在水中的溶解能力。
4.影响因素:溶度积常数只与难溶性电解质的性质和温度有关,而与沉淀的
量和溶液中离子的浓度无关。
5.溶度积规则
某难溶电解质的溶液中任一情况下有关离子浓度幂的乘积为
Q
c
(离子
积)。
当
Q
c
④
<
K
sp
时,溶液不饱和,无沉淀析出;
当
Q
c
⑤
=
K
sp
时,沉淀与溶解处于平衡状态;
当
Q
c
⑥
>
K
sp
时,有沉淀析出,直至达到平衡。
三、难溶电解质的溶解平衡的应用
1.沉淀的生成与溶解
(1)在难溶电解质的溶液中,
当
Q
c
>
K
sp
时,就会生成沉淀
。据此,加入沉淀剂析
出沉淀,是分离、除杂常用的方法。如以Na
2
S、H
2
S等作沉淀剂,使某些金
属离子(如Cu
2+
、Hg
2+
等)生成极难溶的硫化物(CuS、HgS等),从而达到分离
或除杂的目的。
注意
①利用生成沉淀分离或除去某种离子,首先,要使生成沉淀的反应能够发
生;其次,沉淀生成的反应进行得越完全越好。如要除去溶液中的Mg
2+
,可
使用NaOH等使之转化为溶解度较小的Mg(OH)
2
。
②不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的
离子浓度小于1
×
10
-5
mol·L
-1
时,就完全除去。由
K
sp
的表达式可知,使除去的
离子在溶液中残留的浓度尽可能小,需要加入过量的沉淀剂。
(2)当
Q
c
<
K
sp
时,沉淀就会溶解。常用的方法有:
①酸碱溶解法
加入酸或碱与沉淀溶解平衡体系中的相应离子反应,降低相应离子的浓度,
使平衡向沉淀溶解的方向移动。如难溶于水的BaCO
3
可溶于盐酸中。
②发生氧化还原反应使沉淀溶解
某些金属硫化物(如CuS、HgS等),其溶度积特别小,在其饱和溶液中
c
(S
2-
)
特别小。这些金属硫化物能溶于氧化性酸(如硝酸、王水等),S
2-
被氧化,其
浓度减小,从而达到沉淀溶解的目的。
此法适用于那些具有明显氧化性或还原性的难溶物。
③生成配合物使沉淀溶解
向沉淀溶解平衡体系中加入适当的配位剂,使溶液中某种离子生成稳定的
配合物,以减小其离子浓度,从而使沉淀溶解。
如溶解AgCl可加入氨水以生成[Ag(NH
3
)
2
]
+
。
(3)实例探究
①利用沉淀溶解平衡移动原理解释作“钡餐”用BaSO
4
而不用BaCO
3
的原
因。
②误服可溶性钡盐引起中毒,应尽快服用5.0%的Na
2
SO
4
溶液洗胃,使S
与
Ba
2+
结合成沉淀而排出。
③从沉淀溶解平衡的角度解释溶洞的形成。
2.沉淀的转化
(1)沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡的移动。通常,一种沉淀可以转化为更难
溶的沉淀,
两种难溶物的溶解能力差别越大,这种转化的趋势就越大
。
(2)实例探究
①往ZnS的沉淀溶解平衡体系中加入CuSO
4
溶液可将其转化为更难溶的
CuS沉淀。
ZnS(s)+Cu
2+
(aq)
CuS(s)+Zn
2+
(aq)
②依据沉淀转化的原理,可用FeS等难溶物作为沉淀剂除去废水中的某些
金属离子。
FeS(s)+Hg
2+
(aq)
HgS(s)+Fe
2+
(aq)
③硬水中的Mg(HCO
3
)
2
煮沸时分解为MgCO
3
,继续煮沸,MgCO
3
转化为更难
溶的Mg(OH)
2
。
④AgNO
3
溶液
AgCl(白色沉淀)
AgBr(淡黄色沉淀)
AgI(黄
色沉淀)
Ag
2
S(黑色沉淀)。
守恒观 粒子浓度大小的比较及电解质溶液中粒子之间的定量关系
电解质溶液中的粒子之间存在着三种守恒关系,在处理粒子浓度大小
比较及电解质溶液中粒子之间的定量关系时,要学会建立守恒模型、认知
模型,灵活运用模型,化繁为简。
1.粒子浓度大小比较的思路分析
知能拓展
2.电解质溶液中的三种定量关系
(1)电荷守恒
溶液中阳离子所带的正电荷总浓度等于阴离子所带的负电荷总浓度。
如NaHCO
3
溶液中
c
(Na
+
)+
c
(H
+
)=
c
(HC
)+2
c
(C
)+
c
(OH
-
)。
注:1 mol C
带有2 mol 负电荷,所以它的电荷浓度应等于2
c
(C
)。
(2)物料守恒
在电解质溶液中,粒子的种类可能发生变化,但变化前后元素的原子个数守
恒。
如0.1 mol·L
-1
Na
2
CO
3
溶液中
c
(Na
+
)=2
c
未变化
(C
)=2
c
(C
)+2
c
(HC
)+
2
c
(H
2
CO
3
)=0.2 mol·L
-1
。
(3)质子守恒
在电解质溶液中,由于电离、水解等的发生,往往存在质子(H
+
)的得失,但得
到的质子数等于失去的质子数。
如NaHCO
3
溶液中:
c
(H
2
CO
3
)+
c
(H
+
)=
c
(C
)+
c
(OH
-
)
质子守恒关系比较抽象,可以由电荷守恒和物料守恒两种关系导出。
例1(2019湖北八校二联,12)常温下,下列溶液中的微粒浓度关系不正确的
是
( )
A.pH=8.3的某酸式盐NaHB的水溶液中:
c
(Na
+
)>
c
(HB
-
)>
c
(H
2
B)>
c
(B
2-
)
B.等物质的量浓度的Na
2
S和NaHS溶液中:
c
(Na
+
)=2
c
(S
2-
)+
c
(HS
-
)
C.NH
4
HSO
4
溶液中滴加NaOH溶液至恰好呈中性:
c
(Na
+
)>
c
(S
)>
c
(N
)>
c
(OH
-
)=
c
(H
+
)
D.0.1 mol/L NaH
2
PO
4
溶液中:
c
(Na
+
)=
c
(P
)+
c
(HP
)+
c
(H
2
P
)+
c
(H
3
PO
4
)
解题导引 确定溶液中粒子浓度大小关系时,首先确定溶液的组成,分析溶
液中存在的平衡,分清主次(如A项HB
-
的水解程度大于电离程度),注意弱
酸、弱碱的电离和盐的水解程度是微弱的,巧用电荷守恒、物料守恒和质
子守恒(质子守恒可由电荷守恒和物料守恒推出)。
解析 A项,NaHB溶液的pH=8.3,说明HB
-
的水解程度大于电离程度,溶液
中粒子浓度由大到小的顺序为
c
(Na
+
)>
c
(HB
-
)>
c
(H
2
B)>
c
(B
2-
),A项正确。B
项,等物质的量浓度的Na
2
S和NaHS溶液中的电荷守恒式为
c
(Na
+
)+
c
(H
+
)=
c
(OH
-
)+
c
(HS
-
)+2
c
(S
2-
),由于溶液呈碱性,
c
(OH
-
)>
c
(H
+
),故
c
(Na
+
)>
c
(HS
-
)+2
c
(S
2-
),
B项错误。C项,若NH
4
HSO
4
与NaOH以物质的量之比1∶1混合,发生的反
应为2NH
4
HSO
4
+2NaOH
(NH
4
)
2
SO
4
+Na
2
SO
4
+2H
2
O,所得溶液呈酸性;若
NH
4
HSO
4
与NaOH以物质的量之比1∶2混合,发生的反应为NH
4
HSO
4
+
2NaOH
Na
2
SO
4
+NH
3
·H
2
O+H
2
O,所得溶液呈碱性,NH
4
HSO
4
溶液中滴加
NaOH溶液至呈中性,则1∶2<
n
(NH
4
HSO
4
)∶
n
(NaOH)<1∶1,溶液由Na
2
SO
4
、(NH
4
)
2
SO
4
和NH
3
·H
2
O混合而成,溶液中粒子浓度由大到小的顺序为
c
(Na
+
)
>
c
(S
)>
c
(N
)>
c
(OH
-
)=
c
(H
+
),C项正确。D项,根据物料守恒有
c
(Na
+
)=
c
(H
2
P
)+
c
(HP
)+
c
(P
)+
c
(H
3
PO
4
),D项正确。
答案 B
应用观
盐类水解原理在生产、生活中的应用
构建盐类水解的理论模型,树立将理论模型应用于生产、生活的意识,
根据实际条件并运用理论模型和实验方法,解决生产、生活中一些实际的
问题。
1.判断盐溶液的酸碱性
如FeCl
3
溶液显酸性,原因是Fe
3+
+3H
2
O
Fe(OH)
3
+3H
+
。
2.配制或贮存易水解的盐溶液,要考虑盐类水解
如:配制CuSO
4
溶液时,加入少量H
2
SO
4
,抑制Cu
2+
水解。保存Na
2
CO
3
等碱性
盐溶液的试剂瓶不能用玻璃塞,保存NH
4
F溶液不能用玻璃瓶。
3.胶体的制取
制取Fe(OH)
3
胶体: Fe
3+
+3H
2
O
Fe(OH)
3
(胶体)+3H
+
。
4.盐在参加反应时,有时要考虑盐的水解
如:Mg加到NH
4
Cl溶液中:Mg + 2NH
4
Cl
MgCl
2
+2NH
3
↑+ H
2
↑。
5.泡沫灭火器工作原理
主要成分为NaHCO
3
与Al
2
(SO
4
)
3
,发生反应:Al
3+
+ 3HC
Al(OH)
3
↓+3
CO
2
↑。
6.净水原理
如:明矾可作净水剂,原理为Al
3+
+ 3H
2
O
Al(OH)
3
(胶体) + 3H
+
。
7.化肥的使用
铵态氮肥与草木灰不得混用,防止肥效下降。
8.水解除杂原理
根据盐的水解程度不同,通过调节溶液pH使部分离子转化为沉淀而除去。
如CuSO
4
溶液中含Fe
3+
,向溶液中加入CuCO
3
[或CuO、Cu(OH)
2
等]调节溶液
的pH生成Fe(OH)
3
沉淀而除去Fe
3+
。
9.判断溶液中离子能否大量共存,考虑盐类水解
(1)Al
3+
与HC
、C
、Al
、Si
、HS
-
、S
2-
、ClO
-
(2)Fe
3+
与HC
、C
、Al
、Si
、ClO
-
(3)N
与Si
、Al
10.纯碱溶液去油污,越热去污能力越强
原因是C
+H
2
O
HC
+OH
-
,加热促进C
的水解。
11.判断酸的酸碱性
若NaX、NaY、NaZ三种盐pH分别为8、9、10,则酸性:HX>HY>HZ。反
应MA+H
2
O
HA+MOH的水解平衡常数
K
h
=
。水解平衡
常数与电离平衡常数的关系为
K
h
=
或
K
h
=
,若水解平衡常数越大,则
电离平衡常数越小,对应的酸(或碱)的酸性(或碱性)越弱。
12.将某些盐溶液蒸干时,考虑水解
盐溶液蒸干灼烧时所得产物的几种判断类型:
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO
4
(aq)
CuSO
4
(s);盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物,
如AlCl
3
(aq)
Al(OH)
3
Al
2
O
3
。
(2)酸根阴离子易水解的强碱盐,如Na
2
CO
3
溶液等蒸干后可得到原物质。
(3)考虑盐受热时是否分解。Ca(HCO
3
)
2
、NaHCO
3
、KMnO
4
固体受热易分
解,因此蒸干灼烧后分别为Ca(HCO
3
)
2
CaCO
3
(CaO);NaHCO
3
Na
2
CO
3
;KMnO
4
K
2
MnO
4
+MnO
2
。
(4)还原性盐在蒸干时会被空气中O
2
氧化,例如:Na
2
SO
3
(aq)
Na
2
SO
4
(s)。
例2(2018浙江“七彩阳光”联盟联考,8)下列盐类水解的应用不正确的是
( )
A.实验室配制氯化铁溶液时,滴入少量稀硫酸抑制水解
B.为使纯碱溶液的去油污效果更好,可以使用热的纯碱溶液
C.明矾可用于净水,是由于溶于水后产生的Al(OH)
3
胶体具有吸附作用
D.铵态氮肥不能和草木灰混合施用,是由于N
与C
互相促进水解,肥效
下降
解题导引 解决盐类水解在生产、生活中的问题时,要抓住问题的本质,从
原理入手。如配制含Fe
3+
的溶液,需要使用酸抑制Fe
3+
的水解,但又不能引
入杂质;水解反应为吸热反应,加热后水解程度大,加热纯碱溶液,溶液的碱
性增强,碱性越强去油污效果越好。
解析 滴入稀硫酸会引入S
,A不正确;加热会使C
水解程度增大,溶液
碱性增强,使纯碱溶液的去油污效果更好,B正确;明矾的化学式为KAl(SO
4
)
2
·12H
2
O,其溶于水后电离出Al
3+
,Al
3+
水解会产生具有吸附作用的Al(OH)
3
胶
体,故明矾可用于净水,C正确;铵态氮肥中含有N
,草木灰中含有C
,N
与C
互相促进水解,使肥效下降,D正确。
答案 A
利用图像题呈现盐类水解原理及其应用时,通过“单曲线”“双曲线”
“多曲线”图像考查离子浓度的大小比较,反应过程中溶液粒子种类的变
化。根据溶液中多粒子的环境、粒子之间的反应综合分析判断,解决实际
问题。
实践探究
例题(2018山西一模,13)柠檬酸(用H
3
R表示)是一种高效除垢剂,现用一定浓
度的柠檬酸溶液去除水垢,溶液中H
3
R、H
2
R
-
、HR
2-
、R
3-
的含量随pH的变
化曲线如图所示。下列说法中正确的是
( )
A.H
3
R的第二步电离常数
(H
3
R)的数量级为10
-4
B.pH=6时,
c
(R
3-
)=
c
(HR
2-
)>
c
(H
+
)>
c
(OH
-
)
C.Na
2
HR溶液中HR
2-
的水解程度大于电离程度
D.pH=4时,
c
(H
+
)=
c
(H
2
R
-
)+2
c
(HR
2-
)+
c
(OH
-
)
解题导引 多元弱酸先进行第一步电离,然后进行第二步、第三步电离,通
过分析柠檬酸在不同pH情况的电离程度,直接读图,分析出a、b、c、d分
别代表的粒子,紧扣各曲线的交点或指定点进行分析。
解析 根据题图可知,随pH的增大,H
3
R、H
2
R
-
、HR
2-
、R
3-
在图像中对应的
曲线分别为a、b、c、d,H
3
R的第二步电离平衡常数
(H
3
R)=
,当
c
(HR
2-
)=
c
(H
2
R
-
)时,pH约为4.8,
c
(H
+
)=10
-4.8
mol·L
-1
,
的数量
级为10
-5
,A项错误;由图可知,pH=6时,
c
(R
3-
)=
c
(HR
2-
)>
c
(H
+
)>
c
(OH
-
),B项正确;
HR
2-
大量存在的溶液pH约为5,溶液呈酸性,所以Na
2
HR溶液中HR
2-
的水解
程度小于电离程度,C项错误;pH=4时,溶液中的阳离子除H
+
外,还有Ca
2+
、
Mg
2+
等,不符合电荷守恒,D项错误。
答案 B
题目价值 以生活常识“柠檬酸除水垢”为情境,将粒子种类变化和浓度
变化用图像直观地表示出来,体现了运用化学反应原理解决实际问题。
相关文档
- 2021新高考化学鲁科版一轮复习突破2021-07-089页
- 2018届一轮复习鲁科版盐类水解学案2021-07-0710页
- 2019届二轮复习盐类水解沉淀溶解与2021-07-079页
- 2020高中化学 盐类水解反应的应用(2021-07-066页
- 2020届一轮复习人教版盐类水解、沉2021-07-0617页
- 2020届高考化学二轮复习专题二十一2021-07-0620页
- 2019届二轮复习盐类水解沉淀溶解与2021-07-0682页
- 2020届高考化学一轮复习(山东专用)盐2021-07-0615页
- 2019届二轮复习盐类水解沉淀溶解与2021-07-0627页
- 2019届二轮复习盐类水解和沉淀溶解2021-07-0612页