- 309.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高一创新班期中复习题 (二)
第一卷 (选择题共48分)
一、选择题(本题共16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.分类是化学学习和研究的常用手段。下列分类结论正确的是( )
①氨水、氢氧化铝、冰醋酸、氟化氢都是弱电解质 ②HClO、浓硫酸、HNO3均具有强氧化性,都是氧化性酸 ③HI、Na2O2、胆矾都是电解质 ④SiO2、CO2、SO2都是是酸性氧化物,所以它们都能够与水反应生成相应的酸 ⑤漂粉精、氯水、水玻璃、水银都是混合物
A.①②④ B.② C.②③ D.②③④⑤
2.磷中毒可用硫酸铜解毒,反应方程式为:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 分析反应,下列说法错误的是( )
A.P既是氧化剂又是还原剂 B.Cu3P既是氧化产物又是还原产物
C.CuSO4发生了还原反应 D.当生成lmolCu3P时,转移电子的物质的量为6mol
3.下列反应的离子方程式正确的是( )
A.Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO- 3+2OH-=CaCO3↓+CO+H2O
B.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中:Ba2++2OH-+2H++SO=BaSO4↓+2H2O
C.将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO- 3=3Fe3++NO↑+2H2O
4.下列各组离子在指定溶液中能大量共存的是( )
①常温下pH=11的溶液中:CO、Na+、AlO、NO
②加入铝粉能放出H2的溶液中:NH+ 4、Fe2+、NO、SO
③无色透明酸性溶液中:MnO- 4、K+、Al3+、SO
④含有大量Fe3+的溶液中:Na+、Mg2+、Cl-、SCN-
A.①② B.①③④ C.① D. ②③
5.工业上将氨气和空气的混合气体通过铂一铑合金网发生氨氧化反应,若有标准状况下VL氨气完全反应。并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
A. B. C. D.
6..有一粗硅,含铁和硅两种成分,取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等量的氢气,则该粗硅中铁和硅的关系正确的是( )
①物质的量之比为1∶1 ②物质的量之比为2∶1 ③质量之比为4∶1 ④质量之比为2∶1
A.①③ B.①④ C.②③ D.②④
7.在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示。由此确定,原溶液中含有的阳离子是( )
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
8.对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为( )
A.0.40mol B.0.45mol C.0.72mol D.0.80mol
9.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
①0.5molO3与11.2LO2所含的分子数一定相等
②标准状况下,22.4L氯气与足量铝充分反应,转移的电子数为3NA
③通常状况下,NA 个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
⑥在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5 NA个
⑦标准状况下,22.4 L SO3含有的分子数为NA
⑧在常温常压下,1 mol O2含有的原子数为2NA.
⑨物质的量浓度为0.5 mol·L-1 MgCl2溶液中,含有Cl-个数为NA
⑩将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA
A. ①②④⑧ B. ④⑤⑧ C. ③⑥⑨⑩ D. ④⑤⑧⑨
10. 下表中评价合理的是( )
选项
化学反应及其离子方程式
评价
A
向沸腾的蒸馏水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O=Fe(OH)3↓+3H+
正确
B
大理石溶于醋酸的反应: CaCO3+2H+=Ca2++CO2↑+H2O
错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式
C
铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
错误,产物不符合客观事实
D
NaOH溶液中通入少量CO2反应: OH-+CO2=HCO3-
正确
11. 己知49% (溶质的质量分数)硫酸溶液的物质的量浓度为a mol/L,试判断98%硫酸溶液的物
4
质的量浓度为
A. 等于2amol/L B. 大于2amol/L C. 小于2a mol/L D. 无法判断
10. 离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中的H+不可能来自下列物质中的是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤H2CO3
A. ①③ B. ①④⑤ C. ②④⑤ D. ①⑤
11.不用任何试剂鉴别下列五种物质的溶液:①NaOH ②MgSO4③Ba(NO3)2④Cu(NO3)2⑤KNO3被鉴别出来的正确顺序是( )
A.④①②③⑤ B. ④③①②⑤ C. ⑤④③②① D. ②③①④⑤
12.甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,己知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1 mol/L乙溶液中c(H+) >0.1 mol/L;
③向丙容器中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。[来源:Zxxk.Com]
下列结论不正确的是( )
A. 甲溶液含有Ba2+ B. 乙溶液含有SO42-
C. 丙溶液含有Cl- D. 丁溶液含有Mg2+
13.将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
A. Mg和Al的总质量为8g B. 硫酸的物质的量浓度为5mol/L
C. NaOH溶液的物质的量浓度为5mol/L D. 生成的H2在标准状况下的体积为11.2L
14.已知硝酸能将Fe2+氧化为Fe3+.下列物质反应后能使KSCN溶液变红的是( )
①过量的Fe与Cl2反应
②Fe和过量稀硫酸反应
③FeCl2溶液中通入少量Cl2
④Fe和Fe2O3的混合物溶于盐酸中
⑤向Fe(NO3)2溶液中加入过量稀硫酸.
A. 只有① B. 只有①③⑤ C. 只有①②③ D. 全部
15.类推的思维方法在化学学习与研宄中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否。下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;高温下铁与水反应也生成碱和H2
②氢氧化铝加热分解为金属氧化物和水;氢氧化镁、氢氧化铁也能加热分解生成相应的金属氧化物和水
③碳酸钠、碳酸氢钠溶液均显碱性;钠盐溶液均能使酚酞变红
④铝和硫反应生成Al2S3;铁与硫反应生成Fe2S3
A. ③④ B. ①③④ C. ②④ D. ①②③
16.在下列曲线中,纵坐标表示生成Al(OH)3的质量,横坐标表示加入试剂的体积。下列叙述中不正确的是( )
A. 图①可表示向NH3·H2O中滴加AlCl3溶液至过量
B. 图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
C. 图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
D. 图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
第二卷 (非选择题 共52分)
二、填空题(每空2分,共52 分)
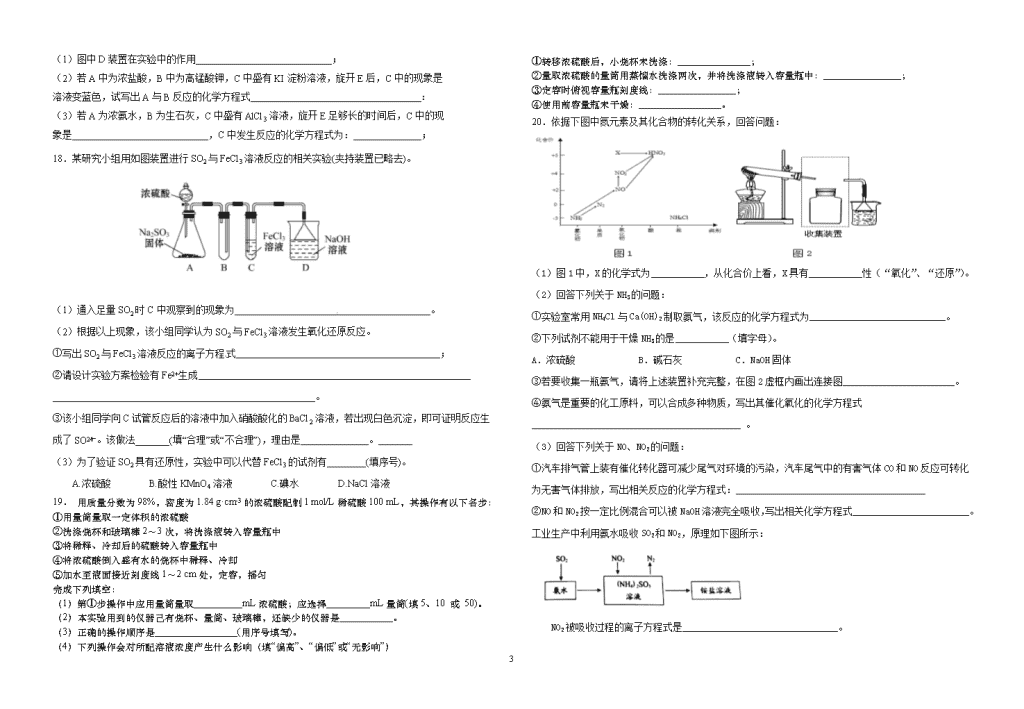
17.用如下图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:
4
(1)图中D装置在实验中的作用 ;
(2)若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是
溶液变蓝色,试写出A与B反应的化学方程式 :
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现
象是 ,C中发生反应的化学方程式为: ;
18.某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
[来源:学.科.网Z.X.X.
(1)通入足量SO2时C中观察到的现象为 。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成 ______________________________________________________。
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO。该做法_______(填“合理”或“不合理”),理由是 。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填序号)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
19. 用质量分数为98%,密度为1.84 g·cm-3的浓硫酸配制1 mol/L稀硫酸100 mL,其操作有以下各步:
①用量筒量取一定体积的浓硫酸
②洗涤烧杯和玻璃棒2~3次,将洗涤液转入容量瓶中[来源:学科网][来源:学§科§网]
③将稀释、冷却后的硫酸转入容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2 cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取__________mL浓硫酸;应选择_________mL量筒(填5、10 或 50)。
(2)本实验用到的仪器己有烧杯、量筒、玻璃棒,还缺少的仪器是___________。
(3)正确的操作顺序是_________________(用序号填写)。
(4)下列操作会对所配溶液浓度产生什么影响(填“偏高”、“偏低”或“无影响”)
①转移浓硫酸后,小烧杯未洗涤:_______________;
②量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中:________________;
③定容时俯视容量瓶刻度线:________________;
④使用前容量瓶未干燥:_________________。
20.依据下图中氮元素及其化合物的转化关系,回答问题:
(1)图1中,X的化学式为___________,从化合价上看,X具有___________性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为____________________________。
②下列试剂不能用于干燥NH3的是___________(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图_______________________。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式___________________________________________ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:_______________________________________
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式________________________。
工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
NO2被吸收过程的离子方程式是________________________________。
4
.Co21.用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如图所示:
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:________________ _________________________。
(2)在实验室过滤操作中所用的玻璃仪器有_____________,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:___ _____________________________________。
(3)该流程中哪些物质可以循环使用:____ _____________________。(用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:________ ______________________________________________________。
m
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
4
相关文档
- 【化学】北京市2018-2019学年高二2021-07-0813页
- 【化学】云南省陆良县联办高级中学2021-07-0815页
- 【化学】四川省仁寿一中南校区20192021-07-088页
- 福建省泉州市2021届新高考模拟化学2021-07-0822页
- 【化学】甘肃省靖远县第四中学20192021-07-0816页
- 高考化学深化复习命题热点提分专题2021-07-0818页
- 【化学】安徽省黄山市屯溪第一中学2021-07-088页
- 化学反应中的热量变化 学案2021-07-086页
- 2021届新高考选考化学一轮复习人教2021-07-085页
- 2018届二轮复习化学反应速率、化学2021-07-08100页