- 1.02 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
2021 届高三年级第一学期期中考试
化 学
2020.11
本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分 100 分,考试时间 90 分钟。
可能用到的相对原子质量:H—1 O—16 Na—23 S—32 Cl—35.5 K—39 I—127
第Ⅰ卷(选择题 共 36 分)
单项选择题:本题包括 8 小题,每小题 2 分,共 16 分。每小题只有一个选项符合题意。
1. 化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
A. 预防新型冠状病毒,可用 95%的医用酒精进行环境消毒
B. 油脂在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
C. 导航卫星中的计算机芯片材料是高纯度的二氧化硅
D. 地沟油经过加工处理后可用来制生物柴油和肥皂
2. 氮氧化物形成雾霾时的部分反应为 N2O5+H2O===2HNO3、HNO3+NH3===NH4NO3。
下列表示反应中相关微粒的化学用语正确的是( )
A. 中子数为 10 的氧原子:1810O B. NH3 的结构式:
C. N 的结构示意图: D. H2O 的电子式:H·
·O·
·H
3. 下列有关物质性质与用途具有对应关系的是( )
A. SO2 具有氧化性,可用作葡萄酒抗氧化剂
B. 氨气具有还原性,可用作制冷剂
C. 次氯酸具有弱酸性,可用作有色物质的漂白剂
D. 碳酸钠溶液显碱性,可用其热溶液除去金属餐具表面油污
4. 室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L-1 HCl 溶液:Na+、NO-
3 、SO2-
4
B. 0.1 mol·L-1 NaOH 溶液:NH+
4 、SO2-
4 、Cl-
C. 0.1 mol·L-1 FeCl3 溶液:K+、SCN-、NO-
3
D. 0.1 mol·L-1NaClO 溶液:Na+、SO2-
4 、I-
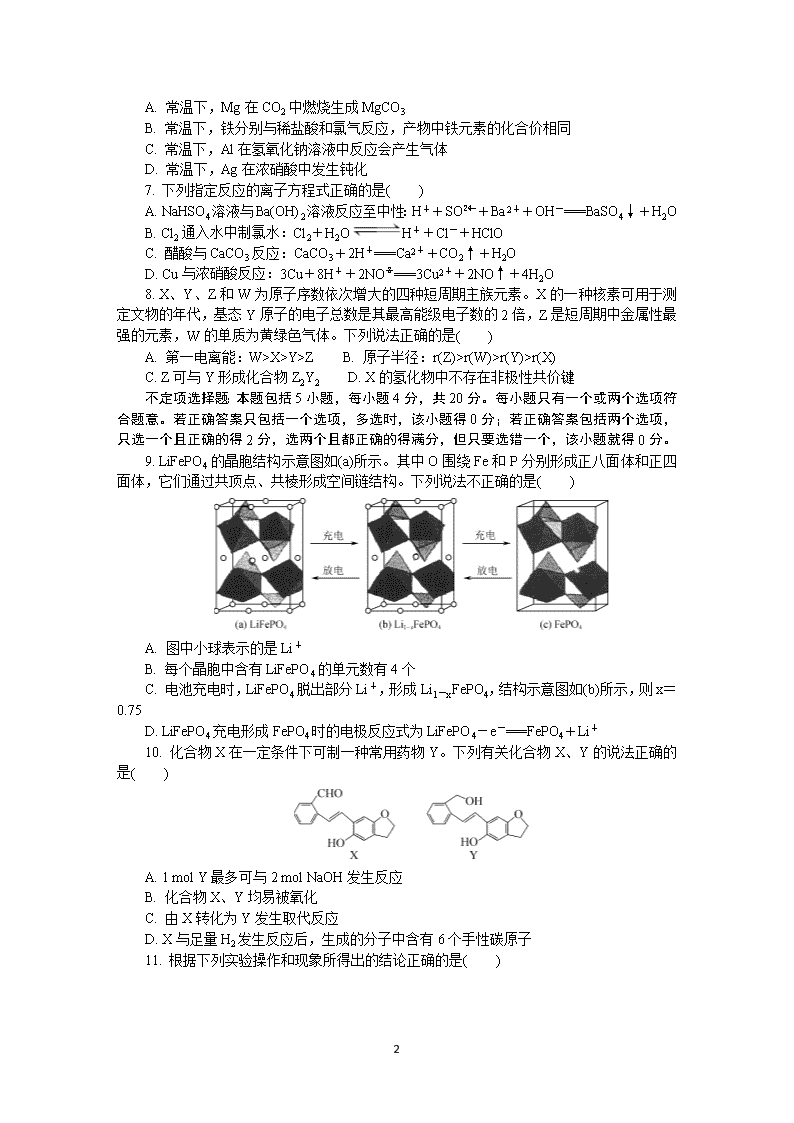
5. 下列实验操作能达到实验目的的是( )
A. 用装置甲从碘水中萃取碘 B. 用图乙所示装置配制银氨溶液
C. 用装置丙检验溶液中是否有 K+ D. 用装置丁将 FeCl3 溶液蒸干制备 FeCl3
6. 下列有关化学反应的叙述正确的是( )
A. 常温下,Mg 在 CO2 中燃烧生成 MgCO3
2
B. 常温下,铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
C. 常温下,Al 在氢氧化钠溶液中反应会产生气体
D. 常温下,Ag 在浓硝酸中发生钝化
7. 下列指定反应的离子方程式正确的是( )
A. NaHSO4 溶液与 Ba(OH)2 溶液反应至中性:H++SO2-
4 +Ba2++OH-===BaSO4↓+H2O
B. Cl2 通入水中制氯水:Cl2+H2O H++Cl-+HClO
C. 醋酸与 CaCO3 反应:CaCO3+2H+===Ca2++CO2↑+H2O
D. Cu 与浓硝酸反应:3Cu+8H++2NO-
3 ===3Cu2++2NO↑+4H2O
8. X、Y、Z 和 W 为原子序数依次增大的四种短周期主族元素。X 的一种核素可用于测
定文物的年代,基态 Y 原子的电子总数是其最高能级电子数的 2 倍,Z 是短周期中金属性最
强的元素,W 的单质为黄绿色气体。下列说法正确的是( )
A. 第一电离能:W>X>Y>Z B. 原子半径:r(Z)>r(W)>r(Y)>r(X)
C. Z 可与 Y 形成化合物 Z2Y2 D. X 的氢化物中不存在非极性共价键
不定项选择题:本题包括 5 小题,每小题 4 分,共 20 分。每小题只有一个或两个选项符
合题意。若正确答案只包括一个选项,多选时,该小题得 0 分;若正确答案包括两个选项,
只选一个且正确的得 2 分,选两个且都正确的得满分,但只要选错一个,该小题就得 0 分。
9. LiFePO4 的晶胞结构示意图如(a)所示。其中 O 围绕 Fe 和 P 分别形成正八面体和正四
面体,它们通过共顶点、共棱形成空间链结构。下列说法不正确的是( )
A. 图中小球表示的是 Li+
B. 每个晶胞中含有 LiFePO4 的单元数有 4 个
C. 电池充电时,LiFePO4 脱出部分 Li+,形成 Li1-xFePO4,结构示意图如(b)所示,则 x
=0.75
D. LiFePO4 充电形成 FePO4 时的电极反应式为 LiFePO4-e-===FePO4+Li+
10. 化合物 X 在一定条件下可制一种常用药物 Y。下列有关化合物 X、Y 的说法正确的
是( )
A. 1 mol Y 最多可与 2 mol NaOH 发生反应
B. 化合物 X、Y 均易被氧化
C. 由 X 转化为 Y 发生取代反应
D. X 与足量 H2 发生反应后,生成的分子中含有 6 个手性碳原子
11. 根据下列实验操作和现象所得出的结论正确的是( )
3
选项 实验内容 实验结论
A
向 1 mL 0.1 mol·L-1 NaOH 溶液中加入 2 mL 0.1
mol·L-1 CuSO4 溶液,振荡后滴加 0.5 mL 葡萄
糖溶液,加热未出现红色沉淀
葡萄糖中不含有醛基
B
向 1 mL 0.2 mol·L-1 NaOH 溶液中滴入 2 滴 0.1
mol·L-1 MgCl2 溶液,产生白色沉淀后,再滴加
2 滴 0.1 mol·L-1 FeCl3 溶液,又生成红褐色沉淀
在相同温度下,
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
C
测定同温度下相同物质的量浓度的碳酸钠和硫
酸钠溶液的 pH,前者大于后者 碳元素非金属性弱于硫
D
向某溶液中滴加少量稀 NaOH 溶液,将湿润的红
色石蕊试纸置于试管口,试纸不变蓝 溶液中不含 NH+
4
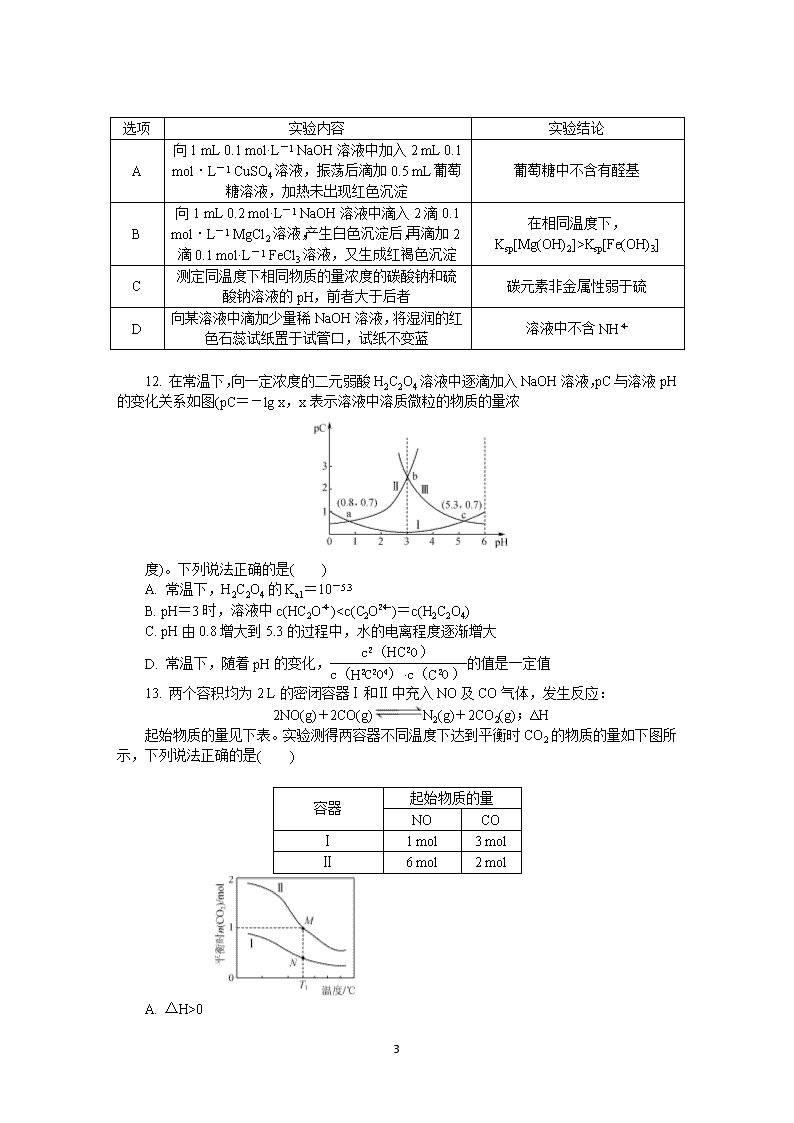
12. 在常温下,向一定浓度的二元弱酸 H2C2O4 溶液中逐滴加入 NaOH 溶液,pC 与溶液
pH 的变化关系如图(pC=-lg x,x 表示溶液中溶质微粒的物质的量浓
度)。下列说法正确的是( )
A. 常温下,H2C2O4 的 Ka1=10-5.3
B. pH=3 时,溶液中 c(HC2O-
4 )0
B. N 点的平衡常数为 0.04
4
C. 若将容器Ⅰ的容积改为 1 L,T1 温度下达到平衡时 NO 的转化率为 25%
D. 图中 M 点所示条件下,再通入 CO、N2 各 2 mol,此时 v(CO,正)>v(CO,逆)
第Ⅱ卷(非选择题 共 64 分)
14. (12 分)今年 6 月比亚迪正式发布采用磷酸铁锂技术的刀片电池,大幅度提高了电动汽
车的续航里程,可媲美特斯拉。可利用钛铁矿[主要成分为 FeTiO3(难溶性亚铁盐),还含有少
量 MgO、SiO2 等杂质]来制备 LiFePO4 和 Li4Ti5O12 等锂离子电池的电极材料,工艺流程如下:
回答下列问题:
(1) “酸浸”后,钛主要以 TiOCl 2-
4 形式存在,写出相应反应的离子方程式:________。
(2) TiO2·xH2O 沉淀与双氧水、氨水“反应”转化成(NH4)2Ti5O15 溶液时,Ti 元素的浸出
率与反应温度的关系如右图所示,反应温度过高时,Ti 元素浸出率变化的原因是________。
(3) “滤液②”中含有的金属离子是________;加入双氧水和磷酸使 Fe3+恰好沉淀完全,
即溶液中 c(Fe3+)=1.0×10-5 mol·L-1,此时溶液中 c(PO3-
4 )=________。(FePO4 的Ksp=1.3×10
-22)
(4) 反应得到 FePO4 固体后需要进行洗涤,洗涤的操作方法是________。
(5) 写出“高温煅烧②”中由 FePO4 制备 LiFePO4 的化学方程式:________。
(6) Li2Ti5O15 中 Ti 的化合价为+4,在 1 mol Li2Ti5O15 中,其中形成过氧键的氧原子数目
为________mol。
15. (14 分)甲氧氯普胺也叫灭吐灵,是常用的止吐药。其一条合成路线如下:
(1) C 中含有的官能团名称为________、________、________。
(2) F→G 的反应类型为________。
(3) X 的分子式为 C6H16N2,写出 X 的结构简式:________。
(4) 写出同时满足下列条件的 D 的一种同分异构体的结构简式:________。
①能发生银镜反应的α氨基酸;
② 1 mol 该物质最多能与 3 mol NaOH 反应;
③分子中只有 6 种不同化学环境的氢。
5
(5) 请写出以 、CH3OH、(CH3CO)2O 为原料制备中间产物化合物 D 的合成路
线流程图(无机试剂可任选,合成路线流程图示例见本题题干)
已知: (易被氧化)。
16. (14 分)Na2S2O3 俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,
在中性或碱性环境中稳定,在 40~45 ℃熔化,48 ℃分解。实验室用 Na2SO3 和过量硫粉(不
溶于水,可溶于乙醇)在水溶液中加热反应制取 Na2S2O3·5H2O 晶体的步骤如下:
(图 1 是有关物质的溶解度曲线)[反应原理:Na2SO3(aq)+S(s)=====
△
Na2S2O3(aq)]
①称取一定量的 Na2SO3 于烧杯中,溶于水。
②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③如图 2 所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④滤液在经过相关实验操作后析出 Na2S2O3·5H2O 晶体。
⑤进行减压过滤并低温干燥。
(1) 图 2 中,仪器 B 的名称是________。
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是____________________。
(3) 实验步骤③中,趁热过滤的原因是____________________。
(4) 实验步骤④中,应采取的相关实验操作为________。
(5) 实验步骤⑤中,采用低温干燥的目的是____________________。
(6) 产品中除了有未反应的 Na2SO3 外,最可能存在的无机杂质是________。
(7) 准确称取 2.00 g 产品,用适量蒸馏水溶解,以淀粉作指示剂,用 0.100 0 mol·L-1 碘
的标准溶液滴定。反应原理为 2S2O2-
3 +I2===S4O2-
6 +2I-。滴定至终点时,溶液颜色的变化是
____________________。消耗碘的标准溶液体积为 36.00 mL,产品的纯度为________。
17. (12 分)CO2 资源化利用受到越来越多的关注,它能有效减少碳排放,有效应对全球的
气候变化,并且能充分利用碳资源。
(1) CO2 催化加氢合成 CH4。
其过程中主要发生下列反应:
反应Ⅰ:CH4(g)+2O2(g)===CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
6
反应Ⅱ:CO(g)+H2O(g)===CO2(g)+H2(g);ΔH=+2.8 kJ·mol-1
反应Ⅲ:2CO(g)+O2(g)===2CO2(g);ΔH=-566.0 kJ·mol-1
则反应 CO2(g)+4H2(g)===CH4(g)+2H2O(g)的ΔH=________kJ·mol-1。
(2) CO2 电化学制 CH4。
图 1 表示以 KOH 溶液作电解质溶液进行电解的示意图,CO2 在 Cu 电极上可以转化为
CH4,该电极反应的方程式为________________________,电解一段时间后,阳极区 KOH 溶
液的质量分数减小,其原因是____________________________________。
(3) CO2 催化加氢合成二甲醚。
反应Ⅰ:CO2(g)+H2(g)===CO(g)+H2O(g);ΔH=41.2 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g);ΔH=-122.5 kJ·mol-1
①反应Ⅱ的平衡常数表达式 K=____________________。
②在恒压、CO2 和 H2 的起始量一定的条件下,CO2 平衡转化率和平衡时 CO 的选择性(CO
的选择性= CO 的物质的量
反应的 CO2 的物质的量
×100%)随温度的变化如图 2。
T℃时,起始投入 3 mol CO2、6 mol H2,达到平衡时反应Ⅰ理论上消耗 H2 的物质的量为
________。合成二甲醚时较适宜的温度为 260 ℃,其原因是________。
18. (12 分)亚铁氰化钾属于批准使用的食品添加剂,受热易分解:
3K4[Fe(CN)6]=====
灼烧
12KCN+Fe3C+2(CN)2↑+N2↑+C
回答下列问题:
(1) 基态 Fe2+与 Fe3+中未成对的电子数之比为________。
(2) 常温常压下 CCl4 为无色液体,CCl4 空间构型为________,它属于________晶体。
(3) NH3、PH3、AsH3 的沸点由高到低的顺序为________(填化学式)。
(4) (CN)2 分子中σ键和π键数目之比为________。
(5) H、C、N 三种元素的电负性由大到小的顺序为________。三种元素组成的化合物 HCN
分子中碳原子的轨道杂化类型为________。
7
2021 届高三年级第一学期期中考试(苏州)
化学参考答案及评分标准
1. D 2. B 3. D 4. A 5. A 6. C 7. B 8. C 9. C 10. BD 11. C 12. CD 13. BD
14. (12 分)(1) FeTiO3+4H++4Cl-===Fe2++TiOCl2-
4 +2H2O(2 分)
(2) 温度过高时,由于双氧水分解与氨气逸出,Ti 元素浸出率下降(2 分)
(3) Fe2+、Mg2+(1 分) 1.3×10-17 mol·L-1(1 分)
(4) 沿玻璃棒向过滤器中加蒸馏水浸没沉淀,待水自然流出,重复操作 2~3 次(2 分)
(5) 2FePO4+Li2CO3+H2C2O4=====
高温
2LiFePO4+H2O↑+3CO2↑(2 分)
(6) 8(2 分)
15. (14 分)(1) 酯基(1 分) (酚)羟基(1 分) 酰胺基(1 分) (2) 取代反应(2 分)
(3) (2 分)
(4) 或 (3 分)
16. (14 分)(1) (球形)冷凝管(1 分)
(2) 硫粉可溶于乙醇,增大反应物的接触面积,加快反应速率(2 分)
(3) 防止温度降低使 Na2S2O3 晶体析出(2 分)
(4) 蒸发浓缩、冷却结晶(2 分)
(5) 防止 Na2S2O3·5H2O 分解(1 分)
(6) Na2SO4(2 分)
(7) 溶液由无色变成蓝色(2 分) 89.28%(2 分)
17. (12 分)(1) -252.9(2 分)
(2) CO2+8e-+6H2O===CH4+8OH-(2 分) OH-在阳极被氧化,钾离子从右室往左室移
动(2 分)
(3) ①K=c(CH3OCH3)·c3(H2O)
c2(CO2)·c6(H2) (2 分)
② 0.3 mol(2 分)
温度过低,反应速率太慢;温度过高,CO 选择性过大,二甲醚的选择性减小(2 分)
18. (12 分)(1) 4∶5(2 分) (2) 正四面体形(1 分) 分子(1 分) (3) NH3、AsH3、PH3(2 分)
(4) 3∶4(2 分) (5) N>C>H(2 分) sp(2 分)