- 839.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
江苏省射阳中学 高二化学上学期期末考试试题苏教版
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24
Si:28 S:32 Cl:35.5 Ca:40 Mn:55 Fe:56 Cu:64 Zn:65
第Ⅰ卷 选择题
单项选择题:本题共 10 小题。每小题 2 分,共计 20 分。每小题只有一个....选项符合题意。
1.2012 年 6 月 16 日我国成功发射了“神州九号”。这标志
着中国人的太空时代又前进了一大步。发射“神九”时
用肼(N2H4)作为火箭发动机的燃料,NO2 为氧化剂,
反应生成 N2 和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol
下列关于肼和 NO2 反应的热化学方程式中,正确的是 ( )
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol
2.在 2A+B 3C+4D 反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
3.在地壳内,深度每增加1 km,压强大约增加25 250 kPa ~30 300 kPa,在这样的压强下,
对固体物质的平衡会发生较大影响。如:
CaAl2Si2O8 + Mg2SiO4 CaMg2Al2Si3O12
(钙长石) (镁橄榄石)(钙镁)石榴子石
摩尔质量(g/mol) 278 140.6 418.6
密度(g/cm3) 2.70 3.22 3.50
在地壳区域变化的条件(深度增加的情况)下,有利于 ( )
A.钙长石生成 B.镁橄榄石生成
C.(钙镁)石榴子石生成 D.钙长石和镁橄榄石共存
4.下列物质属于非电解质,但水溶液能够导电的是 ( )
A.蔗糖 B.NaOH C.CaO D.NH3
5.下列各组离子,在所给条件下一定能大量共存的是 ( )
A.pH=0 的溶液中:Mg2+、Fe3+ 、NO3
— 、SO4
2—
B.能和 Ca2+生成沉淀的溶液中:Ba2+、K+ 、CH3COO—、Cl—
C.加入 Al 能放出 H2 的溶液中:Cl-、HCO3
-、SO4
2-、NH4
+
D.由水电离出的 c(OH—)=1×10-13mol/L 的溶液中:NH4
+、Al3+、NO3
—、Cl—
6.下列说法正确的是 ( )
A.一定温度下,反应 MgCl2(l)=Mg(l)+Cl2(g)的△H >0、△S >0
B.催化剂能缩短反应达到平衡所需的时间,从而提高反应物的转化率
C.25℃时 NH4Cl 溶液的 KW 大于 100℃时 NaCl 溶液的 KW
D.缩小容器的体积,υ(正)增大、υ(逆)减小,平衡向右移动
↑↑↑↓↑
7.25℃时不断将水滴入 0.1mol·L-1 的氨水中,下列图像变化合理的是 ( )
8.用 0.01mol·L-1 H2SO4 和 0.01mol·L-1NaOH 溶液,中和后加水至 100mL。若在滴定时
终点有误差:(1)多滴了 1 滴 H2SO4;(2)少滴了 1 滴 H2SO4(1 滴为 0.05 mL),则
(1)和(2)两种情况下 c(H+)之比的值是 ( )
A.10 B.50 C.5×103 D.104
9.下列表达式错误的是 ( )
A.甲烷的电子式:
B.氮原子的 L 层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12 原子:12 6C
10.等量的苛性钠溶液分别用pH为2和3的醋酸溶液中和,设消耗酸溶液的体积依次为Va、Vb,
两者的关系正确的是 ( )
A.Va>10Vb B.Va=10Vb C.Vb<10Va D.Vb >10Va
不定项选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题只有一个或两个选项.......符合题
意。若正确答案只包括一个选项,多选时,该题得 0 分;若正确答案包括两个选项,只选
一个且正确得 2 分,选两个且都正确得满分,但只要选错一个,该小题就得 0 分。
11.下列化学实验事实及其解释都正确的是 ( )
A.滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了碳
酸钠
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.用洁净的玻璃管向包有 Na2O2 的脱脂棉吹气,脱脂棉燃烧,说明 CO2、H2O 与 Na2O2 反应
是放热反应
D.粗铜精炼时,与电源正极相连的是纯铜,表面析出铜,电极反应式为:
Cu 一 2e-=Cu2+
12.下列溶液中有关物质的量浓度关系正确的是 ( )
A.pH = 2 的 HA 溶液与 pH=12 的 MOH 溶液任意比混合
c(H+) + c(M+)=c(A-) + c(OH-)
B.pH 相等的 CH3COONa、NaOH 和 Na2CO3 三种溶液:
c(NaOH) < c(CH3COONa) < c(Na2CO3)
C.物质的量浓度相等的 CH3COOH 和 CH3COONa 溶液等体积混合
c(CH3COO—) + 2c(OH-) = 2c(H+) + c(CH3COOH)
D.0.1mol·L-1 的 NaHA 溶液,其 pH = 4:c(HA—)>c(H+)>c(H2A)>c(A2-)
13.Li-Al/FeS 电池是一种正在开发的电动车用电池,该电池反应式为:
2Al+ 6Li+ + 3FeS = 2Al3+ + 3Li2S + 3Fe,有关该电池的下列说法中,不正确的是( )
A.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染
B.该电池放电时溶液中 Li+的离子移向正极
C.该电池的负极电极反应式为 Al—3e—=Al3+
D.充电时,阴极发生的电极反应式为 Li2S + Fe —2e—= 2Li+ + FeS
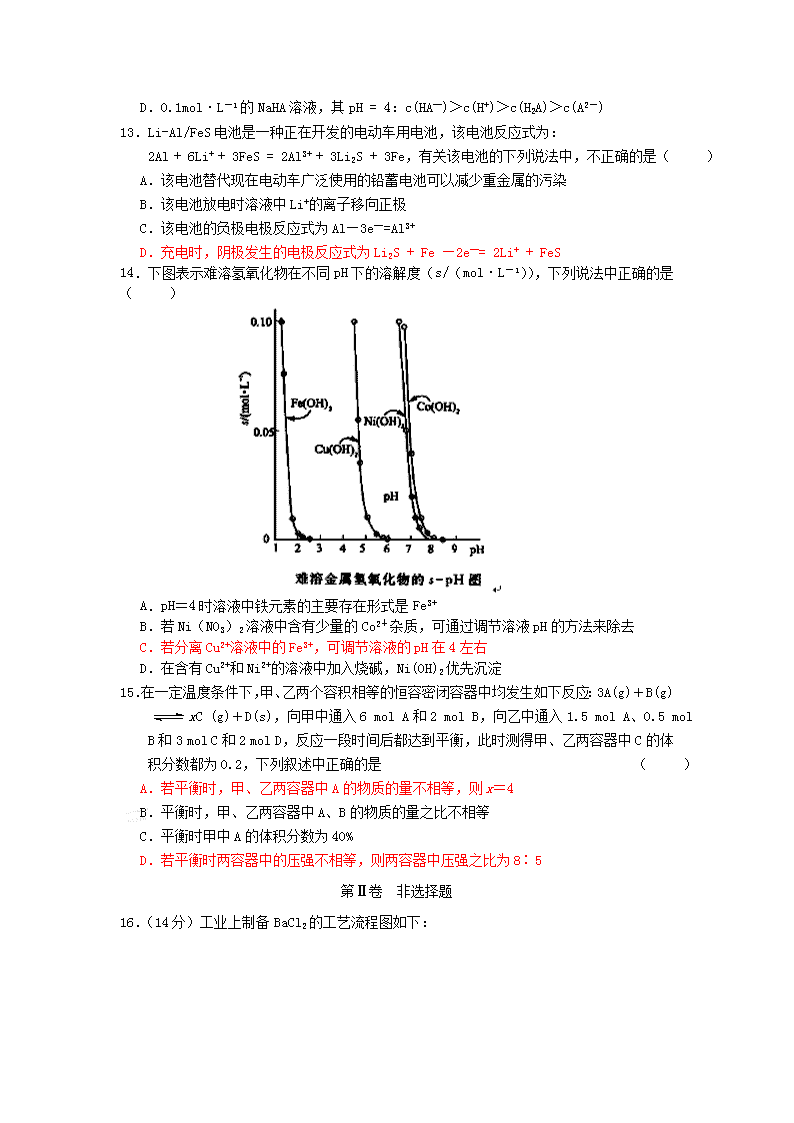
14.下图表示难溶氢氧化物在不同 pH 下的溶解度(s/(mol·L-1)),下列说法中正确的是
( )
A.pH=4 时溶液中铁元素的主要存在形式是 Fe3+
B.若 Ni(NO3)2 溶液中含有少量的 Co2+杂质,可通过调节溶液 pH 的方法来除去
C.若分离 Cu2+溶液中的 Fe3+,可调节溶液的 pH 在 4 左右
D.在含有 Cu2+和 Ni2+的溶液中加入烧碱,Ni(OH)2 优先沉淀
15.在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+
B(g) xC (g)+D(s),向甲中通入 6 mol A 和 2 mol B,向乙中通入 1.5 mol A、
0.5 mol B 和 3 mol C 和 2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容
器中 C 的体积分数都为 0.2,下列叙述中正确的是
( )
A.若平衡时,甲、乙两容器中 A 的物质的量不相等,则 x=4
B.平衡时,甲、乙两容器中 A、B 的物质的量之比不相等
C.平衡时甲中 A 的体积分数为 40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为 8∶5
第Ⅱ卷 非选择题
16.(14 分)工业上制备 BaCl2 的工艺流程图如下:
重晶石矿 高温焙烧
炭
溶解
盐酸
气体
吸收
过滤 结晶滤液 产物
某研究小组在实验室用重晶石(主要成分 BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)
高温
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)
高温
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量 NaOH 溶液吸收,得到硫化钠。Na2S 水解的离子方程式为 。
⑵向 BaCl2 溶液中加入 AgNO3 和 KBr,当两种沉淀共存时, c(Br-)
c(Cl-)
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应 C(s) + CO2(g)
高温
2CO(g)的△H= kJ·mol-1。
⑷在含有弱电解质的溶液中,往往有多个化学平衡共存。
①常温下,将 0.2mol/L 的某一元酸 HA 溶液和 0.1mol/L NaOH 溶液等体积混合后溶液 pH 大
于 7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于 0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
②常温下在 20mL0.1mol/L Na2CO3 溶液中逐滴加入 0.1mol/L
HCl 溶液 40mL,溶液中含碳元素的各种微粒.........(CO2 因逸出未画
出)物质的量分数......(.纵轴..).随溶液 pH 变化的部分情况如右图
所示。回答下列问题:
Ⅰ、在同一溶液中,H2CO3、HCO3
—、 CO3
2—(填:“能”或“不
能”) 大量共存。
Ⅱ、当 pH=7 时,溶液中各种离子其物质的量浓度之间的等量
关系是: 。
Ⅲ、已知在 25℃时,CO3
2— 水解反应的平衡常数 即水解常数 Kh =
c(HCO-3 )·c(OH-)
c(CO2-3 )
=
2×10-4,当溶液中 c(HCO3
—)︰c(CO3
2—)=2︰1 时,溶液的 pH= 。
17.(12 分)能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广
大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池。
①当电解质溶液为稀硫酸时:
Cu 电极是_____( 填“正”或“负”,下同 )极,其电极反应
为 ;
②当电解质溶液为浓硝酸时:Cu 电极是 极,其电极反应为 。
(2)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例 Li2CO3 和 Na2CO3
低熔混合物为电解质。写出 B 极发生的电极反应式: 。
(3)燃烧氢气时耗氧量小,放出热量多。已知 4g H2 燃烧生成液态水时放热为 571.6kJ,试
写出表示 H2 燃烧热的热化学方程式为: 。
18.(12 分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
I、已知 H2A 在水中存在以下平衡:H2A H++HA-,HA- H++A2-。
⑴NaHA 溶液 (选填“显酸性”、 “显碱性”、 “显中性”或“无法确定”)。
⑵某温度下,若向 0.1 mol/L 的 NaHA 溶液中逐滴滴加 0.1 mol/L KOH 溶液至溶液呈中性。
此时该混合溶液中下列关系中,一定..正确的是 。
a.c(H+)·c(OH-)=1×10―14 b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol/L
⑶已知常温下 H2A 的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。
①温度降低时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
II、含有 Cr2O7
2-的废水毒性较大,某工厂废水中含 5.00×10-3 mol·L-1 的 Cr2O7
2-。为使
废水能达标排放,作如下处理:
Cr2O7
2- 绿矾
H+ Cr3+、Fe3+ 石 灰 水 Cr(OH)3、Fe(OH)3
⑷欲使 10L 该废水中的 Cr2O7
2-完全转化为 Cr3+,理论上需要加入 g FeSO4·7H2O。
⑸ 若 处 理 后 的 废 水 中 残 留 的 c(Fe3+) = 2×10 - 13mol·L - 1 , 则 残 留 的 Cr3+ 的 浓 度
为 。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
19.(14 分)以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产
品的工业叫煤化工。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,
①该反应在常温下 自发进行(填“能”与“不能”);
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不
发生变化时,能表明该反应已达到平衡状态的有 。
Ⅰ、混合气体的密度; Ⅱ、容器内气体的压强;
Ⅲ、混合气体的总物质的量; Ⅳ、CO 物质的量浓度
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ D.Ⅰ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气。反应为 H2O(g)+CO(g) H2(g)+CO2(g),某温度下
该反应的平衡常数 K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入 H2(g)
和 CO2(g),其起始浓度如下表所示。下列判断不正确...的是 。
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2 的转化率均是 60%
C.平衡时,丙中c(CO2)是甲中的 2 倍,是 0.012mol/L
D.平衡时,乙中 CO2 的转化率大于 60%
(3)目前工业上有一种方法是用 CO2 来生产甲醇。一定条件下发生反应:CO2(g)+
3H2(g) CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为 kJ•mol—1)的变
化。在体积为 1 L 的恒容密闭容器中,充入 1mol CO2 和 3mol H2 反应
①下列措施中能使 c (CH3OH)增大的是 。
A.升高温度 B.充入 He(g),使体系压强增大
C.将 H2O(g)从体系中分离出来
D.再充入 1mol CO2 和 3mol H2
②在温度 T1 时,当反应达到平衡时,测得 n(H2) = 2.4 mol;其它条件
不
变,在温度 T2 时,当反应达到平衡时,测得 n(CO2) = 0.82 mol,
则 T2 T1。(填“>”、“<”或“=”)
(4)在一定条件下科学家从烟道气中分离出 CO2 与太阳能电池电解水产生的 H2 合成甲醇。
CH3OH、H2 的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol。
①写出工业上以 CO2、H2 合成 CH3OH 和液态水的热化学方程式: ;
②该转化的积极意义是 ;
20.(16 分)孔雀石的主要成分为 Cu2(OH)2CO3,还含少量 Fe、Si 的化合物。实验室以孔雀
石为原料制备 CuCl2·3H2O 及 CaCO3 的步骤如下:
孔雀石
SiO2
溶液A
CO2
Fe(OH)3
·
CaCl2溶液 CaCO3
稀盐酸
CuCl2 3H2O
除杂
过滤 溶液B
气体
操作X
起始浓度 甲 乙 丙
c(H2)/mol/L 0.010 0.020 0.020
c(CO2)/ mol/L 0.010 0.010 0.020
为解决有关问题,兴趣小组同学查得有关物质沉淀的 pH 数据如下:
物质 pH (开始沉淀) pH(完全沉淀)
Fe(OH)3 1.9 3.2
Fe(OH)2 7.0 9.0
Cu(OH)2 4.7 6.7
⑴“除杂”时先通入足量 Cl2 将 Fe2+氧化成 Fe3+,再加入 CuO 固体调节溶液的 pH 至
(填写范围)。检验 Fe(OH)3 是否沉淀完全的实验方案是 。
⑵操作 X 包括 、 、过滤和洗涤等。CuCl2·3H2O 加热灼烧的最终产物的
化学式是 。
⑶某种胃药片的治酸剂为 CaCO3,该药片中 CaCO3 质量分数的测定步骤如下:
a.配制 0.1mol·L-1 的 HCl 溶液和 0.1mol·L-1 的 NaOH 溶液各 250mL。
b.取 0.1g 磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入 25.00mL 0.1 mol·L-1 的 HCl 溶液。
d.以酚酞为指示剂,用 0.1mol·L-1 的 NaOH 溶液滴定,至达到滴定终点。
e.重复 bcd 三步的操作 2 次。
① 操作 c 中量取盐酸体积的仪器是 。
② 若洗涤后的碱式滴定管未用 NaOH 溶液润洗,则所测 CaCO3 的质量分数将 (选
填“偏大”、“偏小”或“无影响”)。
③ 若滴定中 NaOH 溶液的平均用量为 15.00mL,则胃药中碳酸钙的质量分数为 。
21.(12 分)下表为元素周期表中的一部分,列出 10 种元素在元素周期表中的位置。用元素符
号或化学式等规范用语回答下列各问题。
主族
周期 I II III IV V VI VII 0
2 ⑥ ⑦
3 ① ③ ⑤ ⑧ ⑩
4 ② ④ ⑨
(1)10 种元素中,第一电离能最大的是______;电负性最小的金属是______。
(2)①、②、④三种元素最高价氧化物对应的水化物中,碱性最强的是_______。
(3)②、③、⑧三种元素形成的离子,离子半径由大到小的顺序是:_ >__ >__ 。
(4)①和⑤最高价氧化物对应水化物相互反应的离子方程式为:_________ 。
(5)⑦的价电子(外围电子)排布式为:______ 。
射阳中学 2012 年秋学期期末考试高二化学参考答案
选择题
:
16.(14 分,每空 2 分)
⑴S2— + H2O HS— +OH— HS- + H2O H2S +OH— (第二步可不写)
⑵2.7×10-3 ⑶172.5
⑷①D; ②Ⅰ、不能;Ⅱ、c(Na+)+c(H+)=c(Cl-)+c(HCO3
-)+c(OH-);Ⅲ、10。
17.(12 分,每空 2 分)
18.(12 分,每空 2 分)
⑴无法确定 ⑵ bc ⑶ ①减小;②增大 ⑷83.4g ⑸3×10-6mol·L-1
19.(14 分,每空 2 分)
21.(12 分)(1)Ar、K(2)KOH(3)Cl—>K+>Mg2+
(4)OH— + Al(OH)3 === AlO2
— + 2H2O(5)2S22P4
相关文档
- 人教版高二化学镁和铝(第一课时)课件2021-07-0911页
- 广西壮族自治区柳江中学2020-20212021-07-099页
- 江苏省扬州市 2016-2017 学年高二2021-07-0912页
- 人教版高二化学44期末复习之二:有机2021-07-0920页
- 人教版高二化学 醛 章节复习教案2021-07-094页
- 人教版高二化学5-3-2 乙烯和烯烃(第2021-07-092页
- 人教版高二化学 第二节元素周期律2021-07-092页
- 人教版高二化学金属的冶炼(共一课时2021-07-0918页
- 人教版高二化学 第十一章 第三节 2021-07-095页
- 人教版高二化学4-1-3镁和铝(第三课2021-07-093页