- 2.08 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
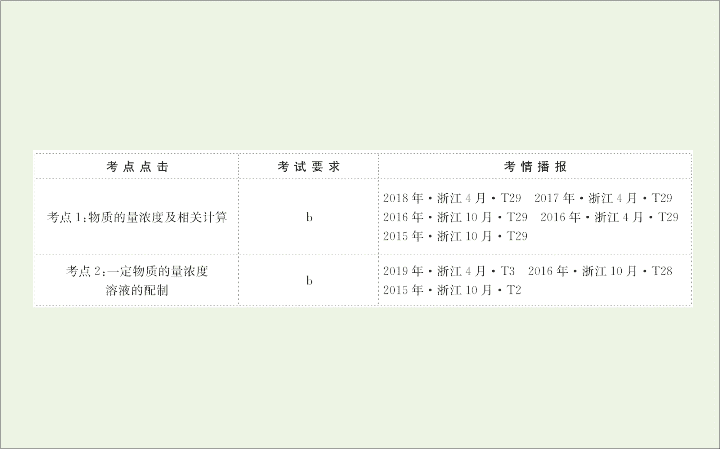
第三单元
溶液的配制及分析
考点
1:
物质的量浓度及相关计算
1.
物质的量浓度
(b)
(1)
含义
:
(2)
相同浓度溶液中某些物理量之间的关系
:
现有两种溶液
:①1 mol·L
-1
KCl
溶液
,②1 mol·L
-1
BaCl
2
溶液
,
请用“相同”或“不同”填写下表
:
取不同体积
的
KCl
溶液
取相同体积
的两种溶液
c
(
溶质
)
_____
_____
ρ
(
溶液
)
_____
_____
n
(
溶质
)
_____
_____
m
(
溶质
)
_____
_____
相同
相同
相同
不同
不同
相同
不同
不同
特点
:
对于某浓度的溶液
,
取出任意体积的溶液
,
其浓
度、密度、质量分数
_____,
但所含溶质的
_________
、
_____
因体积不同而改变。
不变
物质的量
质量
2.
物质的量浓度计算的常见类型
(b)
类型一 标准状况下
,
气体溶质的物质的量浓度的计算
类型二 溶液稀释和同种溶质的溶液混合的计算
(1)
溶液稀释。
①溶质的质量在稀释前后保持不变
,
即
m
1
w
1
=
m
2
w
2
。
②溶质的物质的量在稀释前后保持不变
,
即
c
1
V
1
=
c
2
V
2
。
③溶液质量守恒
,
m
(
稀
)=
m
(
浓
)+
m
(
水
)(
体积一般不守恒
)
。
(2)
溶液混合。
混合前后
:
c
1
V
1
+
c
2
V
2
=
c
混
V
混
,
据此可进行相关计算。
【
典例精析
】
【
典例
】
某温度时
,
有
500 mL
饱和的硫酸镁溶液
,
它的密度是
1.20 g·cm
-3
,
其中镁离子的质量分数是
4.8%,
试回答下列问题
:
(1)
溶质的质量分数
:________
。
(2)
硫酸镁溶液的物质的量浓度
:________
。
(3)
溶质和溶剂的物质的量之比
:________
。
(4)
硫酸根离子的质量分数
:________
。
(5)
该温度下硫酸镁的溶解度
:________
。
【
解题思路
】
本题的解题关键有
:
(1)
溶质的质量分数计算式
:
w
=
溶质的质量
/
溶液的质量
(2)
溶质的物质的量浓度计算式
:
c
=
n/V
(
溶液
)
【
解析
】
(1)
由
Mg
2+
的质量分数知
MgSO
4
的质量分数为
×
4.8%=24.0%
。
(2)
解法一
:
根据定义式计算
,
n
(MgSO
4
)=
n
(Mg
2+
)=
=1.2 mol
c
(MgSO
4
)= =2.4 mol·L
-1
。
解法二
:
直接利用公式计算
,
c
(MgSO
4
)= =2.4 mol·L
-1
。
(3)
根据
MgSO
4
的质量分数
24.0%,
可知
100 g
溶液中含溶
质
24 g,
溶剂
76 g;
则二者的物质的量之比为
≈
1
∶
21
。
(4)
的质量分数为
×
4.8%=19.2%
。
(5)
根据
,
得
S
= g≈31.6 g
。
答案
:
(1)24.0%
(2)2.4 mol·L
-1
(3)1
∶
21
(4)19.2%
(5)31.6 g
【
强化训练
】
1.
V
mL Al
2
(SO
4
)
3
溶液中含有
Al
3+
m
g,
取
mL
该溶液用
水稀释至
4
V
mL,
则
物质的量浓度为
(
)
A.
mol·L
-1
B.
mol·L
-1
C.
mol·L
-1
D.
mol·L
-1
【
解析
】
选
A
。
mL
溶液中
Al
3+
的物质的量为
mol,
稀释后溶液中
Al
3+
的物质的量浓度为
c
(Al
3+
)=
mol·L
-1
,
c
( )=
c
(Al
3+
)=
mol·L
-1
=
mol·L
-1
。
2.
有
Al
2
(SO
4
)
3
和
Na
2
SO
4
的混合溶液
V
L,
将它均分成两
份。一份滴加氨水
,
使
Al
3+
完全沉淀
;
另一份滴加
BaCl
2
溶液
,
使
完全沉淀。反应中消耗
a
mol NH
3
·H
2
O
、
b
mol BaCl
2
。据此得知原混合溶液中的
c
(Na
+
)
为
世纪金榜导学号
(
)
A.
mol·L
-1
B.
mol·L
-1
C.
mol·L
-1
D.
mol·L
-1
【
解析
】
选
C
。根据题意
Al
3+
的物质的量为
mol,
的
物质的量为
b
mol,
因
Na
2
SO
4
和
Al
2
(SO
4
)
3
的混合溶液不显
电性
,
设每份混合溶液中
Na
+
的物质的量为
x
mol,
则根据
电荷守恒可知
, ×3+
x
×1=
b
×2,
x
=2
b
-
a
,
原混合溶液中
的
c
(Na
+
)=
mol·L
-1
。
3.
下列目的能达到的是
(
)
A.
将
58.5 g NaCl
溶于
1 L
水中可得
1 mol·L
-1
的
NaCl
溶液
B.
将标准状况下
22.4 L HCl
溶于
1 L
水中可得
1 mol·L
-1
盐酸
C.
将
25.0 g
胆矾溶于水后配成
100 mL
溶液
,
所得溶液浓度为
1 mol·L
-1
D.
将
78 g Na
2
O
2
溶于水
,
配成
1 L
溶液可得到浓度为
1 mol·L
-1
的溶液
【
解析
】
选
C
。
A
项把溶剂的体积误当作溶液的体积
;B
项不知溶液的体积
;D
项发生反应
:2Na
2
O
2
+2H
2
O====
4NaOH+O
2
↑,
得到的溶液浓度为
2 mol·L
-1
。
4.(1)
将
142 g Na
2
SO
4
配成
2 L
溶液
,
其物质的量浓度为
________mol·L
-1
,Na
+
的物质的量浓度为
___mol·L
-1
,
的物质的量浓度为
________mol·L
-1
。
(2)
下列各溶液中
,Na
+
浓度最大的是
________(
填序号
,
下同
),Na
+
数目最多的是
________
。
①
4 L 0.5 mol·L
-1
NaCl
溶液
②
1 L 0.3 mol·L
-1
Na
2
SO
4
溶液
③
0.8 L 0.4 mol·L
-1
NaOH
溶液
④
2 L 0.15 mol·L
-1
Na
3
PO
4
溶液
【
解析
】
(1)1 mol Na
2
SO
4
配成
2 L
溶液
,
浓度为
0.5 mol·L
-1
,Na
+
和
的浓度分别为
1 mol·L
-1
和
0.5 mol·L
-1
。
(2)
四种溶液中
,Na
+
浓度分别为
0.5 mol·L
-1
、
0.6 mol·L
-1
、
0.4 mol·L
-1
和
0.45 mol·L
-1
,
最大的
是
②
;Na
+
数目分别为
2
N
A
、
0.6
N
A
、
0.32
N
A
和
0.9
N
A
,
最大的
是
①
。
答案
:
(1)0.5
1
0.5
(2)
②
①
【
归纳总结
】
1.
物质的量浓度计算的两个关键
(1)
正确判断溶液的溶质并计算其物质的量。
①与水发生反应生成新的物质
,
如
Na
、
Na
2
O
、
Na
2
O
2
NaOH,SO
3
H
2
SO
4
,NO
2
HNO
3
等。
②含结晶水的物质
:CuSO
4
·
5H
2
O CuSO
4
,
Na
2
SO
4
·
10H
2
O Na
2
SO
4
。
③
特殊物质
:
如
NH
3
溶于水后溶质为
NH
3
·
H
2
O,
但计算浓度
时仍以
NH
3
作为溶质。
(2)
准确计算溶液的体积
,
不能用水的体积代替溶液体积
,
应根据
V
=
计算。
2.
公式计算
n
为溶质的物质的量
,
m
为溶质的质量
,
M
为溶质的摩尔质
量
,
c
为溶质的物质的量浓度
,
V
为溶液的体积。
考点
2:
一定物质的量浓度溶液的配制
1.
主要仪器
(b)
(1)
托盘天平
:
称量前先调零
,
称量时药品放在
_____,
砝
码放在
_____,
读数精确到
____g
。
左盘
0.1
右盘
(2)
容量瓶。
①构造及用途
:
②
查漏操作。
(3)
其他仪器
:
量筒、烧杯、玻璃棒、
_________
等。
胶头滴管
2.
溶液配制
(b)
(1)
配制
250 mL 0.40 mol·L
-1
的
NaCl
溶液
用到的仪器
:_________
、药匙、量筒、烧杯、玻璃棒、
_____________
、
_________
。
托盘天平
250 mL
容量瓶
胶头滴管
(2)
用
18.4 mol·L
-1
的浓硫酸配制
250 mL 1.00 mol·L
-1
的硫酸溶液
用到的仪器
:_____
、烧杯、玻璃棒、
_____________
、
_________
量筒
250 mL
容量瓶
胶头滴管
【
典例精析
】
【
典例
】
(2016·
浙江
10
月选考真题
)
用无水
Na
2
CO
3
固体配制
250 mL 0.100 0 mol·L
-1
的溶液。请回答
:
(1)
在配制过程中不必要的玻璃仪器是
________
。
A.
烧杯
B.
量筒
C.
玻璃棒
D.
胶头滴管
E.
容量瓶
(2)
定容时的操作
:
当液面接近容量瓶刻度线时
,______,
再将容量瓶的瓶塞盖好
,
反复上下颠倒
,
摇匀。
(3)
下列操作会使配得的
Na
2
CO
3
溶液浓度偏低的是
________
。
A.
称取相同质量的
Na
2
CO
3
·10H
2
O
固体进行配制
B.
定容时俯视容量瓶的刻度线
C.
摇匀后发现液面低于容量瓶刻度线
,
再滴加蒸馏水至刻度线
D.
转移洗涤液时洒到容量瓶外
,
继续用该未清洗的容量瓶重新配制
【
解题思路
】
本题的解题关键有
:
(1)
浓度误差的判断方法是将称量
(
或量取
)
误差和定容
误差纳入公式
c
B
=
,
由
m
(B)
和
V
[B(aq)]
判断误差。
(2)
定容时仰视或俯视刻度线产生的误差图解
①
仰视刻度线
(
图
1)
。由于操作时是以刻度线为基准加水
,
从下向上看
,
最先看见的是刻度线
,
刻度线低于液面的实际刻度
,
故加水量偏多
,
导致溶液体积偏大
,
结果偏低。
②俯视刻度线
(
图
2)
。恰好相反
,
刻度线高于液面的实际读数
,
使得加水量偏小
,
结果偏高。
【
解析
】
(1)
用固体溶质配制一定物质的量浓度的溶液
时
,
所需要的仪器有天平、烧杯、玻璃棒、胶头滴管和
容量瓶
;
用液体溶质配制一定物质的量浓度的溶液时
,
所需要的仪器有量筒、烧杯、玻璃棒、胶头滴管和容
量瓶。
(2)
定容时
,
当液面接近容量瓶刻度线时
,
用胶头
滴管滴加蒸馏水至凹液面最低处正好与刻度线相平。
(3)
称取相同质量的
Na
2
CO
3
·10H
2
O
固体进行配制时
,
溶
质
Na
2
CO
3
的质量和物质的量都减小
,
所配溶液浓度偏低
;
定容时俯视容量瓶的刻度线
,
所加水的体积不足
,
则所
配溶液浓度偏高
;
摇匀后发现液面低于容量瓶刻度线
,
是因为部分液体残留在容量瓶的瓶颈上
,
静置一段时间
后会自然流下
,
恢复原状
,
若再滴加蒸馏水至刻度线
,
则
所加水的体积偏大
,
则所配溶液浓度偏低
;
未清洗的容
量瓶中有原溶质残留
,
继续用该未清洗的容量瓶重新配制
,
则溶质的物质的量偏大
,
所配溶液浓度偏高。
答案
:
(1)B
(2)
用胶头滴管滴加蒸馏水至凹液面最低处正好与刻度线相平
(3)A
、
C
【
强化训练
】
1.
下列配制的溶液浓度偏高的是
(
)
A.
配制盐酸用量筒量取盐酸时俯视刻度线
B.
配制盐酸定容时
,
仰视容量瓶刻度线
C.
称量
4 g NaOH
配制
0.1 mol·L
-1
NaOH
溶液
1 000 mL
时
,
砝码错放在左盘
D.NaOH
溶解后未经冷却即注入容量瓶至刻度线
【
解析
】
选
D
。俯视刻度线
,
将会使量得的盐酸的体积小于计算值
,A
项浓度偏低
;
定容时仰视容量瓶刻度线
,
将会导致加水量增多
,B
项浓度偏小
;
由于所称
NaOH
固体的质量为整数
,
不需移动游码
,
故称得固体
NaOH
的质量是准确的
,C
项不影响浓度
;
因热胀冷缩之故
,
会使容量瓶中的溶液在冷却后液面低于刻度线
,D
项浓度偏高。
2.
用固体样品配制一定物质的量浓度的溶液
,
需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
(
)
【
解析
】
选
B
。
A
项
,
托盘天平使用时应“左物右码”
,
图为“左码右物”
,
错误
;C
项
,
移液时不能将烧杯中的溶液直接倒入容量瓶
,
应用玻璃棒引流
,
错误
;D
项
,
胶头滴管应在容量瓶口垂直正上方
,
不能伸入瓶内
,
错误。
3.
实验室配制
0.1 mol·L
-1
的
BaCl
2
溶液
,
分成两个阶段进行
:
第一阶段
:
用托盘天平称取
5.2 g
无水
BaCl
2
晶体。第二阶段
:
溶解配制成
0.1 mol·L
-1
的
BaCl
2
溶液。
世纪金榜导学号
(1)
第二阶段操作
,
应先将
5.2 g BaCl
2
晶体加适量蒸馏水溶解
,
溶解过程中使用的主要仪器有
____________,
然后将溶液转入
____________
中
,
再经
____________
、
________
、
________
后即可得到
0.1 mol·L
-1
的
BaCl
2
溶液。
(2)
下列操作使配制的
BaCl
2
溶液浓度偏低的是
_____
。
A.
如果将砝码放在左盘上
,BaCl
2
晶体放在右盘上进行称量
B.
如果选用的容量瓶内有少量蒸馏水
C.
如果定容摇匀后
,
液面下降
,
又加水至刻度线
D.
如果整个配制过程中
,
容量瓶不振荡
【
解析
】
(1)
溶解过程主要仪器为烧杯、玻璃棒
,
经计算取用
250 mL
容量瓶
,
接下来操作为洗涤、定容、摇匀。
(2)A.
将砝码放错位置后
,
称量的
BaCl
2
的质量偏低。
B.
无影响。
C.
摇匀后再加水即增大了溶液的体积
,
故偏低。
D.
不振荡
,
整个溶液不均匀
,
溶液浓度也不均匀。
答案
:
(1)
烧杯、玻璃棒
250 mL
容量瓶 洗涤 定容 摇匀
(2)AC
【
加固训练
】
1.
下列配制溶液的操作和结论中
,
说法正确的是
(
)
A.
用浓硫酸配制稀硫酸时
,
量取浓硫酸时俯视液面
,
所配得溶液浓度偏小
B.
用
Na
2
CO
3
固体配制溶液时
,
用托盘天平称量固体左码右物
,
对结果一定有影响
C.
用
NH
4
Cl
固体配制溶液时
,
溶解后未恢复至室温就将溶解液转移入容量瓶
,
所配得溶液浓度偏大
D.
定容后发现容量瓶内壁刻度线上部有水珠
,
对浓度无影响
【
解析
】
选
A
。量取浓硫酸时俯视液面
,
使得量取的浓硫酸的量偏小
,
溶液浓度偏小
,A
正确
;
托盘天平称量固体时物码放反
,
若没有使用游码
,
对结果无影响
,B
错误
;
铵盐溶解吸热
,
溶解后未回温
,
配得溶液体积偏大
,
浓度偏小
,C
错误
;
定容后刻度线上有水珠
,
溶液体积偏大
,
浓度偏小。
2.
实验室配制
500 mL 0.2 mol·L
-1
的
Na
2
SO
4
溶液
,
实验操作步骤有
:
A.
在天平上称取
14.2 g
硫酸钠固体
,
把它放在烧杯中
,
用适量的蒸馏水使它完全溶解并冷却至室温。
B.
把制得的溶液小心地转移至容量瓶中。
C.
继续向容量瓶中加蒸馏水至液面距刻度线
1
~
2 cm
处
,
改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.
用少量蒸馏水洗涤烧杯和玻璃棒
2
~
3
次
,
每次洗涤的液体都小心注入容量瓶
,
并轻轻振荡。
E.
将容量瓶瓶塞塞紧
,
充分摇匀。
请填写下列空白
:
(1)
操作步骤的正确顺序为
(
填序号
) ___________
。
(2)
本实验用到的基本仪器已有烧杯、天平
(
带砝码、镊子
)
、玻璃棒
,
还缺少的仪器是
________
、
________
、
____________
。
(3)
下列情况会使所配溶液浓度偏大的是
(
填序号
)________
。
A.
某同学观察液面的情况如图所示
B.
没有进行上述的
D
项操作步骤
C.
加蒸馏水时
,
不慎超过了刻度线
D.
砝码上黏附有杂质
【
解析
】
(1)
配制一定物质的量浓度溶液的步骤为计算、称量、溶解、转移、洗涤、定容、摇匀。
(2)
还需要
500 mL
容量瓶、胶头滴管和药匙。
(3)A
俯视使体积减小
,
故使浓度偏大
;B
未进行洗涤
,
使溶质减小
,
故使浓度偏小
;C
项使体积增大
,
故浓度偏小
;D
使称量的溶质质量增大
,
故使浓度偏大。
答案
:
(1)ABDCE
(2)
药匙 胶头滴管
500 mL
容量瓶
(3)AD
【
归纳总结
】
溶液配制过程中的误差分析
(
以配制
NaOH
溶液为例
)
能引起误差的一些操作
影响因素
对
c
/mol
·
L
-1
的影响结果
m
V
砝码与物品颠倒
(
使用游码
)
减小
—
偏 低
称量时间过长
减小
—
NaOH
放在滤纸上称量
减小
—
向容量瓶注液时少量溅出
减小
—
未洗涤烧杯和玻璃棒
减小
—
定容时
,
水多用滴管吸出
减小
—
定容摇匀后液面下降再加水
—
增大
定容时仰视读数
—
增大
能引起误差的一些操作
影响因素
对
c
/mol
·
L
-1
的影响结果
m
V
砝码沾有其他物质或已生锈
增大
—
偏 高
溶液未冷却至
室温就注入容量瓶定容
—
减小
定容时俯视读数
—
减小
称量前小烧杯内有水
—
—
不 变
定容后经振荡、摇匀
,
静置液面下降
—
—
相关文档
- 高中化学专题化学家眼中的物质世界2021-08-0628页
- 2020_2021学年高中化学专题1化学家2021-07-0911页
- 2020_2021学年高中化学专题1化学家2021-07-086页
- 高中化学专题化学家眼中的物质世界2021-07-0837页
- 2021版新高考化学一轮复习专题1化2021-07-0867页
- 2021版新高考化学一轮复习专题1化2021-07-0868页
- 2020_2021学年高中化学专题1化学家2021-07-076页
- 2021版新高考化学一轮复习专题1化2021-07-0729页
- 2021版高考化学一轮复习专题1化学2021-07-0776页
- 2020_2021学年高中化学专题1化学家2021-07-068页