- 1.46 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
5
课时
金属和金属材料
主题一 身边的化学物质
【
考试要求
】
1.
了解金属的物理特征。
(B)
2.
认识金属材料在生产、生活和社会发展中的重要作用。
(B)
3.
知道在金属中加入其他元素可以改变金属材料的性能。
(A)
4.
知道生铁和钢等重要的合金。
(A)
5.
认识常见金属的主要化学性质。
(B)
6.
认识金属生锈的条件
,
了解防止金属锈蚀的简单方法。
(B)
7.
知道一些常见金属
(
铁、铝等
)
矿物。
(A)
8.
知道可用铁矿石炼铁。
(A)
9.
认识废弃金属对环境的影响和回收金属的重要性。
(B)
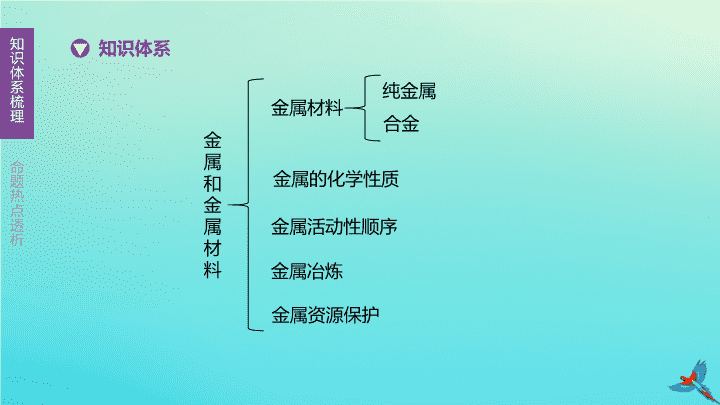
金属和金属材料
知识体系
金属的化学性质
金属活动性顺序
金属冶炼
纯金属
合金
金属材料
金属资源保护
导电
导热
延展
银白色
铜
固态
汞
Cu
Fe
Al
Ca
混合物
大
低
好
Mg
Cu
强
Fe
2
O
3
提供热量
,
制取还原剂
CO
3CO+Fe
2
O
3
2Fe+3CO
2
O
2
H
2
O
Fe
2
O
3
·
x
H
2
O
疏松
稀盐酸
清洁和干燥
刷漆
不锈钢
防止金属锈蚀
寻找金属的替代品
重点梳理
1.
水的电解实验
化学性质
条件及通式
化学方程式
现象及解释
注意
金属与氧
气反应
条件
:
多数金属能与氧气反应
,
但反应的难易和剧烈程度不同
通式
:
金属
+
氧气→金属氧化物
(
属于
①
反应
)
Al:
②
________________
___________
铝在常温下与氧气反应
,
银白色表面逐渐变暗
铝的抗腐蚀性能好不是因为其化学性质稳定
,
而是因为铝在常温下与氧气反应生成了致密的
⑤
Cu:③
_______________
_________
铜在空气中不能燃烧
,
加热时
,
生成
④
色固体
化合
4Al+3O
2
2Cu+O
2
黑
氧化铝薄膜
2Al
2
O
3
2CuO
(续表)
化学性质
条件及通式
化学方程式
现象及解释
注意
活泼金属与稀
酸反应
条件
:
氢前金属
(K
、
Ca
、
Na
除外
)
通式
:
金属
+
酸→盐
+
氢气
(
属于
⑥
反应
)
镁与稀盐酸、稀硫酸
:
⑦
_______________________________
⑧
_______________________________
剧烈
反应
,
产生大量
⑨
,
放出大量热
铁与酸反应生成的盐为亚铁盐
(
即铁的化合价为
+2)
金属与酸反应后
,
溶液的质量均增加
铁与稀盐酸、稀硫酸
:
⑩
_______________________________
⑪______________________________
反应
缓慢
,
产生气泡
,
溶液由无色
变为
⑫
色
置换
Mg+2HCl MgCl
2
+H
2
↑
Mg+H
2
SO
4
MgSO
4
+H
2
↑
气泡
Fe+2HCl FeCl
2
+H
2
↑
浅绿
Fe+H
2
SO
4
FeSO
4
+H
2
↑
(续表)
化学性质
条件及通式
化学方程式
现象及
解释
注意
金属与某些可
溶性盐溶液反应
条件
:
前置换后
(K
、
Ca
、
Na
除外
),
盐可溶
通式
:
金属
+
盐→新盐
+
新金属
(
属于
⑬
反应
)
Fe
与
CuSO
4
溶液
:
⑭______________
_________________
铁表面
有
⑮
色的固体生成
,
溶液
由
⑯
_____
色
变为浅绿色
铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱
若金属表面有“锈”即“氧化膜”
,
应先用砂纸打磨干净
,
再做实验
置换
Fe+CuSO
4
红
蓝
FeSO
4
+Cu
(续表)
化学性质
条件及通式
化学方程式
现象及
解释
注意
金属与某些可
溶性盐溶液反应
条件
:
前置换后
(K
、
Ca
、
Na
除外
),
盐可溶
通式
:
金属
+
盐→新盐
+
新金属
(
属于
⑬
反应
)
Cu
与
AgNO
3
溶液
:
⑰
_______________
__________________
________
铜表面
有
⑱
色的物质生成
,
溶液由无色
变为
⑲
色
铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱
若金属表面有“锈”即“氧化膜”
,
应先用砂纸打磨干净
,
再做实验
置换
Cu+2AgNO
3
银白
蓝
Cu(NO
3
)
2
+
2Ag
(续表)
化学性质
条件及通式
化学方程式
现象及
解释
注意
金属与某些可
溶性盐溶液反应
条件
:
前置换后
(K
、
Ca
、
Na
除外
),
盐可溶
通式
:
金属
+
盐→新盐
+
新金属
(
属于
⑬
反应
)
Al
与
CuSO
4
溶液
:
⑳
_______________
_________________
_______
铝表面
有
㉑
色的物质生成
,
溶液由蓝色
变为
㉒
色
铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱
若金属表面有“锈”即“氧化膜”
,
应先用砂纸打磨干净
,
再做实验
置换
2Al+3CuSO
4
红
无
Al
2
(SO
4
)
3
+
3Cu
2.
实验室模拟炼铁
实验装置
实验原理
㉓__________________________________
3CO+Fe
2
O
3
2Fe+3CO
2
(续表)
实验步骤
(1)
先通纯净的
CO
一段时间——原因
:
㉔____________________________________
(2)
再点燃酒精喷灯
,
给
Fe
2
O
3
加热——目的
:
使氧化铁和一氧化碳发生反应
(3)
实验结束
,
先停止加热再停止通入
CO(CO
早出晚归
,
酒精喷灯迟到早退
)
——原因
:
一是
㉕
二是
㉖
排尽玻璃管内的空气
,
防止加热时发生爆炸
防止液体倒吸
防止新生成的铁在较高温度下被
空气中的氧气再次氧化
(续表)
实验现象
玻璃管内
:
㉘
试管中
:㉙
最右端导管口
:
有
㉚
色火焰产生
实验反思
一氧化碳是有毒气体
,
本实验尾气处理方法
是
㉛
,
还可以用气囊收集
该实验可验证
CO
的
㉗
、
㉜
的化学性质
红色粉末变为黑色
澄清石灰水变浑浊
蓝
点燃
还原性
可燃性
3.
铁制品锈蚀条件探究
编号
Ⅰ
Ⅱ
Ⅲ
实验图示
生锈程度
㉝_____________
㉞_____________
㉟__________
不生锈
不生锈
生锈
(续表)
编号
Ⅰ
Ⅱ
Ⅲ
对比分析
实验
Ⅰ
、
Ⅲ
说明铁生锈一定
与
㊱
有关
;
实验
Ⅱ
、
Ⅲ
说明铁生锈一定与
㊲
有关
;
实验
Ⅰ
蒸馏水煮沸后使用的原因是
㊳
结论
分析对比实验
Ⅰ
、
Ⅱ
、
Ⅲ
可知
,
铁生锈的条件
是
㊴
O
2
H
2
O
除去水中溶解的氧气
Fe
与
O
2
、
H
2
O
同时接触
易错判断
1.
合金一定是由两种或多种金属熔合而成
(
)
2.
合金都是混合物
,
属于合成材料
(
)
3.
金刚石、生铁、氧化铁、磁铁矿都是合金
(
)
4.
“真金不怕火炼”说明金的化学性质稳定
(
)
5.
铝具有良好的抗腐蚀性是因为铝很难与氧气发生反应
(
)
6.
铁丝在氧气中燃烧生成黑色的氧化铁
(
)
7.
铁与稀盐酸反应
:2Fe+6HCl 2FeCl
3
+3H
2
↑
(
)
8.
经常用钢丝球擦洗铝锅表面保持洁净
(
)
9.
高炉炼铁得到的产物是纯铁
(
)
×
×
×
√
×
×
×
×
×
化学方程式网络构建
图
5-1
考向一 金属材料
(
6
年
6
考)
1.
[2019
·
河北
]
下列有关金属及合金的说法错误的是
(
)
A.
常温下所有的金属都是固体
B.
铁制品在潮湿的空气中易生锈
C.
生铁和不锈钢都是金属材料
D.
铝片表面易生成致密的氧化膜
[
答案
]A
[
解析
]
汞是金属
,
但是常温下是液体。
2.
[2018
·
河北节选
]
理化知识在生产、生活中有着广泛的应用。保险丝
(
铅锑合金
)
比组成它的纯金属的熔点
。
3.
[2017
·
河北
]
锰钢比组成它的纯金属硬度
,
可用于制作钢轨。
低
大
4.
拓展
下列有关铜和铜的合金说法不正确的是
(
)
A.
黄铜是混合物
B.
黄铜和纯铜互相刻画
,
黄铜上会有划痕
C.
黄铜比纯铜耐腐蚀
D.
银的导电性比铜好
,
但经常用铜作导线
[
答案
]
B
[
解析
]
所有合金都是混合物
;
合金的硬度比组成它的纯金属要大
,
所以纯铜上有划痕
;
合金的抗腐蚀性比纯金属要好
;
性质并不是决定用途的唯一因素
,
价格、资源等都会影响物质的用途
,
银的导电性虽然很好
,
但价格昂贵
,
所以不用银作导线。
考向二 金属的化学性质
(
6
年
6
考)
5.
[2019
·
河北
]
将一定量的铁粉加入到含有
Cu(NO
3
)
2
和
AgNO
3
的废液中
,
充分反应后过滤
,
向滤渣中加入稀盐酸
,
无气泡产生。下列判断正确的是
(
)
A.
滤渣中一定含有
Ag
和
Cu,
滤液中一定含有
Fe(NO
3
)
2
B.
滤渣中一定不含
Fe,
滤液中一定含有
Fe(NO
3
)
2
和
Cu(NO
3
)
2
C.
滤渣中一定含有
Ag,
滤液中可能含有
Cu(NO
3
)
2
和
AgNO
3
D.
滤渣中一定含有
Ag
和
Cu,
滤液中可能含有
Cu(NO
3
)
2
和
AgNO
3
[
答案
]
C
[
解析
]
将一定量的铁粉加入到含有
Cu(NO
3
)
2
和
AgNO
3
的废液中
,
铁先和硝酸银反应
,
硝酸银反应完之后铁再和硝酸铜发生反应。向滤渣中加入稀盐酸
,
无气泡产生
,
因此滤渣中一定不含铁
,
一定含有银
,
可能含有铜
;
滤液中一定含有硝酸亚铁
,
可能含有硝酸铜和硝酸银。
6.
[2015
·
河北
]
金属
M
与
AgNO
3
溶液发生反应
:M+2AgNO
3
M(NO
3
)
2
+2Ag
。下列说法正确的是
(
)
A.M
可能是铝
B.Ag
的金属活动性比
M
强
C.
反应前后
M
的化合价发生了改变
D.
在金属活动性顺序里
,M
一定排在氢前
C
7.
[2014
·
河北
]
等质量的
X
、
Y
两种金属分别和足量同体积、同浓度的盐酸反应
,
产生气体的质量与时间的关系如图
5-2
所示。下列说法错误的是
(
)
A.
t
1
时
,
产生气体的质量
:X>Y
B.
t
2
时
,
消耗金属的质量
:X>Y
C.
t
3
时
,
消耗金属的质量
:X=Y
D.
t
3
时
,
消耗盐酸的质量
:X=Y
图
5-2
[
答案
]
D
[
解析
]
从图像分析可知
:
t
1
时
,X
、
Y
两种金属都没有消耗完
,X
产生氢气的质量大于
Y;
依题意可知
,X
、
Y
两金属质量相等
,
t
2
时
,X
恰好反应完
,Y
还未反应完
,
故消耗
X
的质量大于
Y;
t
3
时
,
两反应都已结束
,
故消耗
X
的质量等于
Y;
当消耗等质量的金属
X
、
Y
时
,
生成氢气质量多的
X
消耗的盐酸质量也多。
8.
[2016
·
河北
]
下列验证
Zn
、
Fe
、
Ag
三种金属活动性顺序的实验方案中
(
“
-
”表示未进行金属与盐溶液之间的实验
),
不能达到实验目的的是
(
)
[
答案
]C
[
解析
]
银不能与硫酸锌反应
,
说明锌的金属活动性比银强
;
锌能与硫酸亚铁溶液反应
,
说明锌的金属活动性比铁强
,C
中组合不能验证
Fe
、
Ag
两种金属的活动性顺序。
选项金属盐溶液
A
B
C
D
ZnSO
4
溶液
-
Fe
Ag
Fe
FeSO
4
溶液
Zn
Ag
Zn
-
AgNO
3
溶液
Fe
-
-
Fe
9.
[2018
·
河北
]
如图
5-3
所示的四个图像
,
分别对应四种过程
,
其中正确的是
(
)
A.①
分别向等质量
Mg
和
Cu
中加入足量等质量、等浓度的稀硫酸
B.②
分别向等质量且足量的
Zn
中加入等质量、不同浓度的稀硫酸
C.③
分别向等质量且足量的
Mg
和
Zn
中
,
加入等质量、等浓度的稀硫酸
D.④
分别向等质量的
Mg
和
Zn
中加入等质量、等浓度且足量的稀硫酸
图
5-3
[
答案
]
C
[
解析
]
铜不能和稀硫酸反应生成氢气
,
故
A
选项错误
;
金属过量
,
酸完全反应
,
所以浓度大的稀硫酸产生的氢气多
,
故
B
选项错误
;
等质量、足量的镁和锌与等质量、等浓度的稀硫酸反应
,
产生氢气的质量相同
,
并且镁比锌活泼
,
所以镁反应速率较快
,C
选项正确
;
等质量的镁和锌与足量的等质量、等浓度的稀硫酸反应
,
镁产生的氢气较多
,
并且镁反应的速率较快
,
故
D
选项错误。
10.
拓展
[2019
·
黄石
]
用盐酸与金属单质反应
,
探究锌、镁、铜的金属活动性
(
如图
5-4)
。下列有关现象、分析或结论正确的是
(
)
A.
铜片表面可以观察到气泡
B.
锌片的试管比镁片的试管更热
C.
金属活动性由强到弱顺序为
:
镁
>
锌
>
铜
D.
三支试管中盐酸溶液的质量分数可以不同
图
5-4
[
答案
]
C
[
解析
]
由于铜位于金属活动性顺序表中氢之后
,
不能与酸反应
,
无气泡产生
;
镁与盐酸反应速率比锌快
,
则镁片的试管比锌片的试管更热
;
镁与盐酸反应的速率比锌快
,
铜与盐酸不反应
,
则金属活动性由强到弱的顺序为镁
>
锌
>
铜
;
在探究金属活动性顺序时需控制变量
,
则盐酸应等质量、等质量分数。
11.
拓展
向硫酸亚铁和硫酸铜的混合物中加入一些锌粉
,
充分反应后过滤
,
得到固体不溶物
A
和滤液
,
向
A
中放入少量的稀硫酸
,
有气体生成。则
A
中一定含有
,
可能含有
,
滤液中一定含有的溶质是
,
一定没有的溶质是
,
可能含有的溶质是
。
[
答案
]
铜和铁 锌 硫酸锌 硫酸铜 硫酸亚铁
[
解析
]
在金属活动顺序表中锌和铜的距离比锌和铁的距离远
,
所以锌先和硫酸铜反应。若锌很少
,
就只和硫酸铜反应
,
没有将硫酸铜反应完
,
则滤渣中只有铜
,
滤液中有生成的硫酸锌和剩余的硫酸铜以及未反应的硫酸亚铁
;
若锌刚好把硫酸铜反应完
,
则滤渣中有铜
,
滤液中有硫酸锌和硫酸亚铁
;
若锌把硫酸铜反应完
,
还有剩余
,
再和硫酸亚铁反应
,
但锌的量不足以把硫酸亚铁反应完
,
则滤渣中有铜和铁
,
滤液中有硫酸锌和剩余的硫酸亚铁
;
若锌刚好把硫酸亚铁也反应完
,
则滤渣中有铜和铁
,
滤液中只有硫酸锌
;
若锌把硫酸亚铁也反应完
,
锌还有剩余
,
则滤渣中有铜、铁和锌
,
滤液中只有硫酸锌。
A
中加入稀硫酸有气体生成
,
说明滤渣中有铜和铁
,
或者是滤渣中有铜、铁和锌
;
滤液中一定有硫酸锌
,
因为固体中已经有铁被置换出来
,
说明硫酸铜已经反应完
,
所以滤液中一定没有硫酸铜
,
但可能硫酸亚铁没被完全反应
,
所以可能有硫酸亚铁。
【
方法点拨
】
金属与酸反应涉及三个量
:
反应物质量、生成物质量、反应速率。金属与酸反应图像类型
:
气体
-
时间图、气体
-
金属图、气体
-
稀酸图。其中只有气体
-
时间图可以反映反应的速率
,
从而判断金属的活动性顺序。
足量金属
与等量酸反应
①
如图甲
,
金属活动性
:Mg>Zn>Fe
②
生成氢气质量
(
由酸质量决定
):Mg=Fe=Zn
③
如图乙
,
消耗金属质量
(
由相对原子质量与化合价的比值决定
,
比值越小消耗金属质量越少
):MgZn>Fe
②
生成氢气质量
(
由相对原子质量
与
化合价
的比值决定
,
比值越小生成氢气越多
):Mg>Fe>Zn
③
如图丁
,
消耗硫酸质量
(
由生成氢气质量决定
):Mg>Fe>Zn
考向三 铁的冶炼
(
6
年
4
考)
12.
拓展
[2019
·
眉山
]
某化学兴趣小组用以下装置探究炼铁原理。关于该装置和反应过程描述错误的是
(
)
A.
盛放药品前应先检查装置气密性
B.
开始时要先通
CO,
再加热
;
结束时
,
先停止加热
,
继续通一氧化碳直至
试管冷却
C.
已知方框中连接的是
C
和
D,
导管
口的连接顺序为
a
→
b
→
c
→
d
D.
这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
图
5-5
[
答案
]
C
[
解析
]
由于
a
端的尾气中含有
CO,CO
有毒且难溶于水
,
则需收集在
C
瓶中
,
所以导管口的连接顺序为
a→c→b→d
。
考向四 金属的锈蚀与防护
(
6
年
5
考)
13.
[2017
·
河北
]
某同学根据铜绿的成分
Cu
2
(OH)
2
CO
3
作出猜想
:
金属铜锈蚀的条件除有氧气和水外
,
还必须有二氧化碳。为证明“必须有二氧化碳”
,
需要进行如图
5-6
所示实验中的
(
)
A.
甲和乙
B.
甲和丁
C.
乙和丁
D.
丙和丁
图
5-6
[
答案
]
B
[
解析
]
从铜锈成分可以知道铜生锈是铜和水、氧气、二氧化碳共同作用的结果
,
探究二氧化碳对金属锈蚀的影响
,
应该在其他条件相同时进行实验。甲和乙两组实验中其他条件相同
,
甲有氧气
,
乙没有氧气
,
探究的是氧气对实验的影响。甲和丁两组实验中其他条件相同
,
甲中有二氧化碳
,
丁中没有
,
能探究二氧化碳对实验的影响。乙和丁相同的条件是水和铜
,
乙中有二氧化碳
,
丁中有氧气
;
丙和丁相同的条件是铜和氧气
,
丙中有二氧化碳
,
丁中有水
,
两组均不符合探究方法
,
不能控制变量进行探究。
14.
[2018
·
河北
]
如图
5-7
是探究影响铁锈蚀快慢因素的实验。为探究氯化钠是否可以加快铁的锈蚀
,
试管
①
中的物质
X
和试管
②
中的物质
Y
分别是
。
图
5-7
[
答案
]
氧气、氯化钠溶液
[
解析
]
探究氯化钠对铁生锈的影响需要控制其他量不变
,
所以
X
应该是氧气
,Y
是氯化钠溶液。
15.
[2016
·
河北
]
化学与生产、生活有密切联系。
菜刀使用后可以采取
(
答一条即可
)
的措施防锈。
16.
[2015
·
河北
]
生活与化学密切相关。
铁制品容易生锈的环境是
。
擦干
,
保持干燥
(
或涂一层油
)
潮湿的空气
题型链接
1.
两个烧杯中装有等质量的金属锌和镁
,
然后分别逐渐加入同浓度的稀硫酸
,
产生氢气的质量与加入硫酸的质量关系如图
5-8
所示。下列说法正确的是
(
)
A.
该图反映出镁比锌的金属活动性强
B.
a
点时
,
两个烧杯中的酸都恰好完全反应
C.
b
点时
,
两个烧杯中产生氢气的质量相等
D.
c
点时
,
两个烧杯中都有金属剩余
图
5-8
[
答案
]
D
[
解析
]
从图中可以看出
,
横坐标表示加入硫酸的质量
,
故此图不能反映出金属的活动性强弱
;a
点时
,
镁比锌产生的氢气质量多
,
则镁比锌消耗硫酸的质量也多
;b
点时
,
镁比锌产生的氢气质量多
;c
点时
,
两种金属都没有反应完
,
故两个烧杯中都有金属剩余。
2.
请据图
5-9
所示实验回答问题。
(1)
甲
:
实验目的是
______________________
。
(2)
乙
:
铝丝与硫酸铜溶液反应的现象是
______________________________________
____________
。某位同学在进行铝和硫酸
铜溶液反应的实验时
,
未能观察到明显现
象
,
可能的原因是
。
(3)
丙
:
发生反应的化学方程式为
______________
_________________,
该实验需做的改进是
。
探究反应物之间的
铝丝表面有红色物质生成
,
溶液由蓝色
图
5-9
铝丝没有打磨
(
合理即可
)
3CO+Fe
2
O
3
增加尾气处理装置
接触面积对反应速率的影响
变为无色
2Fe+3CO
2
3.
图
5-10
是初中化学中六种常见物质之间的转化关系图
,
部分生成物已略去。已知
A
、
D
、
F
均为单质
,
其中
D
、
F
为金属单质
,D
的合金是使用最多的金属材料
,B
为氧化物
,C
是一种常见的酸
,E(
相对分子质量为
160)
的溶液呈蓝色。试回答下列问题。
(1)
写出
B
的化学式
:
。
(2)
上述反应中
,
不属于置换反应的是
(
填序号
)
。
(3)
反应
④
的化学方程式
:
。
(4)E
在生产、生活中的一种用途
。
图
5-10
[
答案
]
(1)CuO
(2)③
(3)CuSO
4
+ Fe Cu+FeSO
4
(4)
制农药
[
解析
]
D
的合金是使用最多的金属材料
,
故
D
是铁
;E(
相对分子质量为
160)
的溶液呈蓝色
,
说明含有铜离子且相对分子质量为
160,
可确定为
CuSO
4
;B
是氧化物
,C
是常见的酸且能与
B
反应生成硫酸铜
,
故
C
为硫酸
,B
为氧化铜
;A
为单质
,
硫酸与活泼金属反应生成氢气
,
故
A
是氢气
;F
为单质
,
氧化铜能与氢气反应生成铜
,
故
F
为铜。
相关文档
- 新课标RJ2020中考化学复习方案主题2021-11-1047页
- 河北专版2020中考化学复习方案主题2021-11-108页
- 包头专版2020中考化学复习方案主题2021-11-1020页
- 新课标RJ2020中考化学复习方案主题2021-11-109页
- 2020中考化学复习方案主题三身边的2021-11-1010页
- 新课标RJ2020中考化学复习方案主题2021-11-1023页
- 安徽专版2020中考化学复习方案主题2021-11-1063页
- 河北专版2020中考化学复习方案主题2021-11-1047页
- 北京专版2020中考化学复习方案主题2021-11-108页
- 包头专版2020中考化学复习方案主题2021-11-108页