- 913.73 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第10课时 生活中常见的盐
考题分层训练
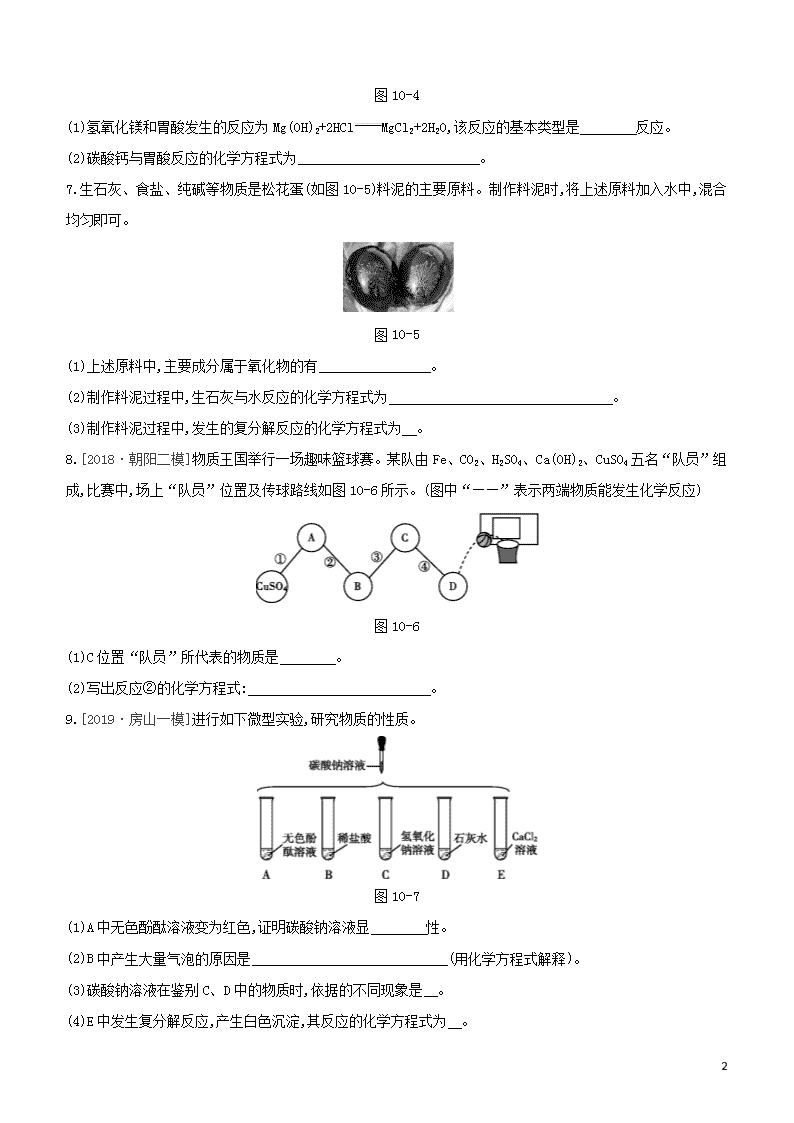
考点1 常见的盐的物理性质及用途
1.能用于治疗胃酸过多症的物质是 ( )
A.蔗糖 B.食盐 C.小苏打 D.食醋
2.雯雯来到博物馆门口。同学们在地质学家李四光的大理石雕像前,了解他的生平事迹。大理石的主要成分是 。
3.[2018·房山一模]重庆小面美味的秘诀之一是在制作时加入纯碱,纯碱的化学式是 。
4.[2018·丰台一模]将下面的物质与其相应的用途连线。
图10-3
考点2 盐的化学性质
5.[2018·东城一模]生活中常见的物质:
①水(H2O) ②钙片(主要成分为CaCO3)
③小苏打(NaHCO3) ④干冰(CO2)
(1)属于氧化物的有 (填序号)。
(2)②的主要成分和③都能与稀盐酸反应,反应的化学方程式分别为 、 。
6.[2018·石景山一模]请完成下面的填空。
如图10-4为“胃酸完全抑制剂”的标签:
[药品名称] 胃酸完全抑制剂
[主要成分] 每片内含碳酸钙800 mg
氢氧化镁116 mg
[用途] 用于胃酸过多、消化不良等
[用法用量] 口服,一次1片,每日2次
6
图10-4
(1)氢氧化镁和胃酸发生的反应为Mg(OH)2+2HClMgCl2+2H2O,该反应的基本类型是 反应。
(2)碳酸钙与胃酸反应的化学方程式为 。
7.生石灰、食盐、纯碱等物质是松花蛋(如图10-5)料泥的主要原料。制作料泥时,将上述原料加入水中,混合均匀即可。
图10-5
(1)上述原料中,主要成分属于氧化物的有 。
(2)制作料泥过程中,生石灰与水反应的化学方程式为 。
(3)制作料泥过程中,发生的复分解反应的化学方程式为 。
8.[2018·朝阳二模]物质王国举行一场趣味篮球赛。某队由Fe、CO2、H2SO4、Ca(OH)2、CuSO4五名“队员”组成,比赛中,场上“队员”位置及传球路线如图10-6所示。(图中“——”表示两端物质能发生化学反应)
图10-6
(1)C位置“队员”所代表的物质是 。
(2)写出反应②的化学方程式: 。
9.[2019·房山一模]进行如下微型实验,研究物质的性质。
图10-7
(1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显 性。
(2)B中产生大量气泡的原因是 (用化学方程式解释)。
(3)碳酸钠溶液在鉴别C、D中的物质时,依据的不同现象是 。
(4)E中发生复分解反应,产生白色沉淀,其反应的化学方程式为 。
6
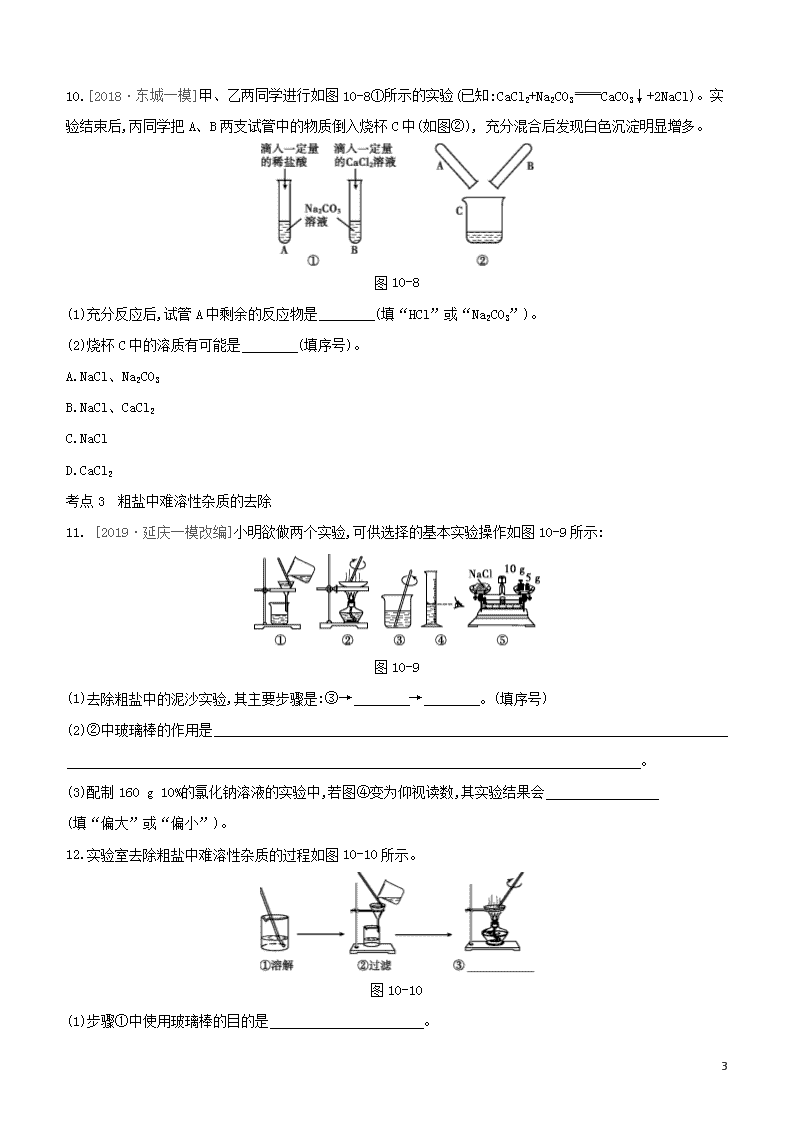
10.[2018·东城一模]甲、乙两同学进行如图10-8①所示的实验(已知:CaCl2+Na2CO3CaCO3↓+2NaCl)。实验结束后,丙同学把A、B两支试管中的物质倒入烧杯C中(如图②), 充分混合后发现白色沉淀明显增多。
图10-8
(1)充分反应后,试管A中剩余的反应物是 (填“HCl”或“Na2CO3”)。
(2)烧杯C中的溶质有可能是 (填序号)。
A.NaCl、Na2CO3
B.NaCl、CaCl2
C.NaCl
D.CaCl2
考点3 粗盐中难溶性杂质的去除
11. [2019·延庆一模改编]小明欲做两个实验,可供选择的基本实验操作如图10-9所示:
图10-9
(1)去除粗盐中的泥沙实验,其主要步骤是:③→ → 。(填序号)
(2)②中玻璃棒的作用是
。
(3)配制160 g 10%的氯化钠溶液的实验中,若图④变为仰视读数,其实验结果会
(填“偏大”或“偏小”)。
12.实验室去除粗盐中难溶性杂质的过程如图10-10所示。
图10-10
(1)步骤①中使用玻璃棒的目的是 。
6
(2)步骤②中过滤器的制作如图10-11,正确的顺序是 (填序号)。
图10-11
(3)步骤③的名称是 。当观察到 时,停止加热。
(4)在上述粗盐提纯的过程中,利用到氯化钠的物理性质有
(答一条即可)。
物质的除杂是一项重要的实验技能。下列除杂质的方法中,不正确的是 ( )
选项
物质
杂质
除杂质的方法
A
CaCl2
CaCO3
加足量的水溶解,过滤,对滤液进行蒸发
B
Na2CO3溶液
NaOH
加入适量的CaCO3,过滤
C
FeCl2溶液
CuCl2
加入过量的铁粉,过滤
D
CO2
CO
通过灼热的CuO
6
【参考答案】
夯实基础
1.C
2.碳酸钙
3.Na2CO3
4.碳酸钙——补钙剂 小苏打——发酵粉
5.(1)①④
(2)CaCO3 + 2HClCaCl2+H2O+CO2↑
NaHCO3+HClNaCl+H2O+CO2↑
6.(1)复分解
(2) CaCO3+2HClCaCl2+H2O+CO2↑
7.(1)生石灰 (2)CaO+H2OCa(OH)2
(3)Ca(OH)2+Na2CO3CaCO3↓+2NaOH
8.(1)Ca(OH)2 (2)Fe+H2SO4FeSO4+H2↑
9.(1)碱
(2)Na2CO3+2HCl2NaCl+H2O+CO2↑
(3)C中无明显变化、D中石灰水变浑浊
(4)Na2CO3+CaCl22NaCl+CaCO3↓
[解析](1)酚酞溶液遇碱性物质变红色,A中无色酚酞溶液变为红色,证明碳酸钠溶液显碱性。(2)向稀盐酸中滴加碳酸钠溶液,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl2NaCl+H2O+CO2↑。(3)氢氧化钠中加入碳酸钠溶液不反应,无明显现象,石灰水中加入碳酸钠溶液,碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀。(4)氯化钙溶液中加入碳酸钠溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为Na2CO3+CaCl22NaCl+CaCO3↓。
10.(1)Na2CO3 (2)ABC
[解析]根据题目中信息可知,充分混合后发现白色沉淀明显增多,可推知一定生成了新的碳酸钙沉淀,则必然有钙离子和碳酸根离子参与反应,说明A、B试管中分别有这两种离子中的一种剩余,由此可以判断出,A中剩余碳酸钠,B中剩余氯化钙。因此,A试管反应结束后,溶质为生成的氯化钠和过量的碳酸钠,B试管反应结束时,溶质为生成的氯化钠和过量的氯化钙。当A、B同时倒入C烧杯后,C中一定含有氯化钠,还会发生碳酸钠与氯化钙的反应,应用“生成物一定有,反应物可能有”的原则,反应结束后,烧杯C中的溶质中一定有氯化钠,可能有碳酸钠或者氯化钙。
11.(1)① ② (2)搅拌,防止局部受热不均,造成液滴飞溅 (3)偏小
6
[解析](1)去除粗盐中的泥沙,步骤为溶解、过滤、蒸发。(2)玻璃棒在溶解中起加速溶解的作用,在过滤中的作用是引流,在蒸发中的作用是搅拌,防止液滴飞溅。(3)量取液体时,仰视读数会使量取的水体积偏大,则所配制溶液的溶质质量分数会偏小。
12.(1)加快溶解 (2)CAB (3)蒸发 有较多的固体析出 (4)氯化钠易溶于水
能力提升
B [解析]杂质碳酸钙是难溶于水的沉淀,而CaCl2可溶于水,故可以通过加水然后过滤的方法除去,碳酸钙为滤渣,氯化钙溶液为滤液,再对滤液进行蒸发,可得到氯化钙固体;杂质氢氧化钠不与碳酸钙反应;铁粉可与氯化铜反应,将氯化铜转化为氯化亚铁,同时生成铜,再过滤将生成的铜和过量的铁粉除掉;一氧化碳具有还原性,可与灼热的氧化铜反应,使一氧化碳转化为二氧化碳。
6
相关文档
- 江苏专版2020中考化学复习方案第042021-11-113页
- 包头专版2020中考化学复习方案主题2021-11-1116页
- 安徽专版2020中考化学复习方案主题2021-11-1122页
- 河北专版2020中考化学复习方案主题2021-11-1110页
- 河北专版2020中考化学复习方案主题2021-11-118页
- 新课标RJ2020中考化学复习方案主题2021-11-116页
- 包头专版2020中考化学复习方案主题2021-11-1113页
- 北京专版2020中考化学复习方案主题2021-11-1111页
- 北京专版2020中考化学复习方案主题2021-11-117页
- 新课标RJ2020中考化学复习方案主题2021-11-1154页