- 613.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
22.(2015•乐山)下列日常生活常见的金属中,金属活动性最强的是(C)
A.Fe B.Cu C.Al D.Zn
8.(2015•南京)现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属
的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系 ( 如
下 图 所 示 )。 则 三 种 金 属 的 活 动 性 由 强 到 弱 的 顺 序 是 ( C
)
A.乙、甲、丙
B.乙、丙、甲
C.丙、甲、乙
D.丙、乙、甲
7.(2 分)(2015•南充)现有 X、Y、Z 三种金属,已知:①X+Y(NO3)2=X(NO3)2+Y,
②把 Y、Z 两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应.这三种金属的活动性由弱
到强的顺序是( A )
A.Z<Y<X B.Y<X<Z C.X<Y<Z D.Z<X<Y
13.(2 分)(2015•自贡)为比较 X、Y、Z 三种金属活动性大小,进行如下四个实验.从所
述实验现象得出正确结论是( A )
A.X>Y>Z B.Z>Y>X C.Y>X、Y>Z D.X>Y、Z>Y
12.(2 分)(2015•巴中)往 AgNO3 和 Cu(NO3)2 的混合溶液中加入一定量的铁粉,充分
反应后过滤,向滤渣中加入稀盐酸,有气泡产生.根据上述现象分析,你认为下面结论错误
的是( D )
A.滤渣一定有 Fe 粉 B.滤渣一定有 Cu 粉
C.滤液中一定有 Fe2+ D.滤液中一定有 Ag+、Cu2+
10.(2015•佛山)已知:2Al+Fe2O3
高
—
温
—2Fe+Al2O3;2Na+2H2O——2NaOH+H2↑。下表各选项
中不能用置换反应通过 X 得到 Y 的一组物质是( A )
选项 A B C D
X Fe Fe2O3 Na Zn
Y FeCl3 Al2O3 NaOH ZnCl2
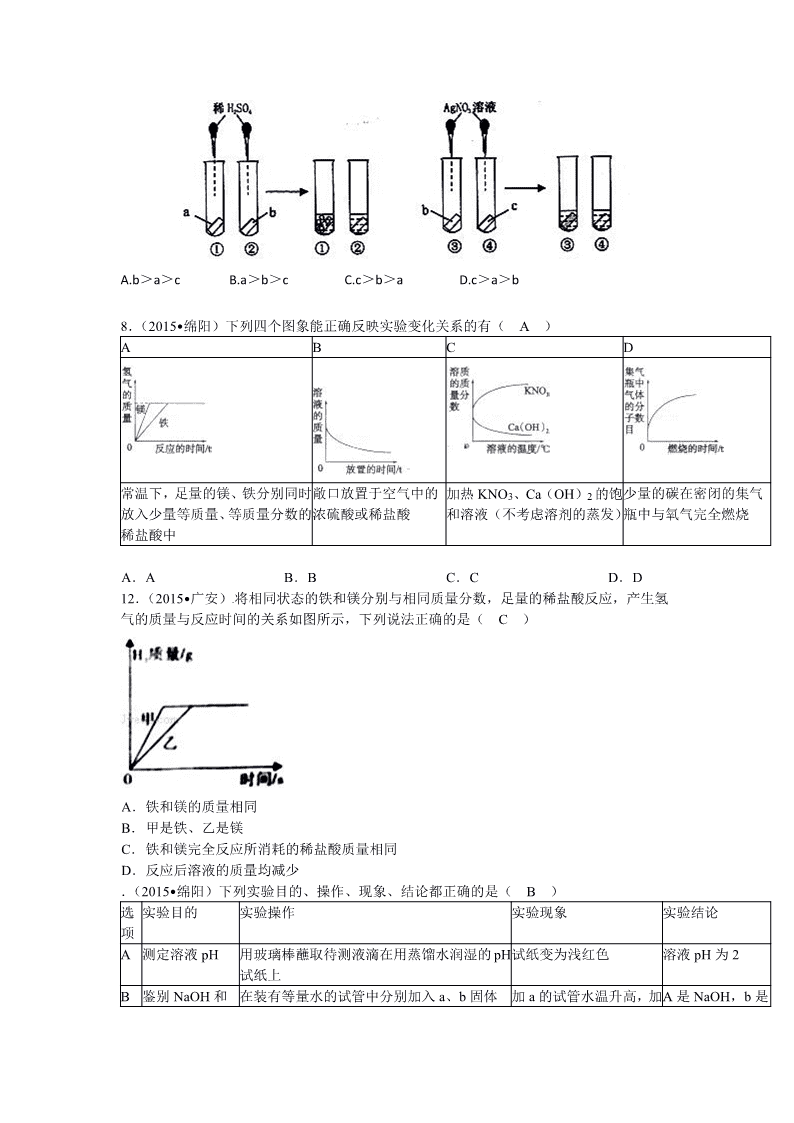
12.(2015•佛山)为了探究 a、b、c 三种金属活动性顺序,某同学设计了如下实验。实验结
论正确的是( B )
A.b>a>c B.a>b>c C.c>b>a D.c>a>b
8.(2015•绵阳)下列四个图象能正确反映实验变化关系的有( A )
A B C D
常温下,足量的镁、铁分别同时
放入少量等质量、等质量分数的
稀盐酸中
敞口放置于空气中的
浓硫酸或稀盐酸
加热 KNO3、Ca(OH)2 的饱
和溶液(不考虑溶剂的蒸发)
少量的碳在密闭的集气
瓶中与氧气完全燃烧
A.A B.B C.C D.D
12.(2015•广安)将相同状态的铁和镁分别与相同质量分数,足量的稀盐酸反应,产生氢
气的质量与反应时间的关系如图所示,下列说法正确的是( C )
A.铁和镁的质量相同
B.甲是铁、乙是镁
C.铁和镁完全反应所消耗的稀盐酸质量相同
D.反应后溶液的质量均减少
.(2015•绵阳)下列实验目的、操作、现象、结论都正确的是( B )
选
项
实验目的 实验操作 实验现象 实验结论
A 测定溶液 pH 用玻璃棒蘸取待测液滴在用蒸馏水润湿的 pH
试纸上
试纸变为浅红色 溶液 pH 为 2
B 鉴别 NaOH 和 在装有等量水的试管中分别加入 a、b 固体 加 a 的试管水温升高,加A 是 NaOH,b 是
NH4NO3 b 的试管水温降低 NH4NO3
C 验证燃烧是否
需要 O2
做白磷是否燃烧的对比实验 前者不燃烧,后者燃烧 燃烧需要 O2
D 比较 Al、Cu 的
活泼性
将未经打磨的 Al 条放入 CuSO4 溶液中 无明显现象 Al 的活性炭低于
Cu
A.A B.B C.C D.D
16.(2015•眉山)往 200gFeCl3 和 CuCl2 的混合溶液中加入铁
粉。己知反应的先后顺序和化学方程式分 别为:2FeCl3 + Fe =
3FeCl2 CuCl2 + Fe = FeCl2 + Cu 。下图为加入铁粉的质量与
反应后剩余固体质量关系。则下列说法不正确的是( A )
A.B 点后溶液的颜色为蓝色
B.D 点对应纵坐标为 6.4
C.该 200g 溶液中的 CuCl 质量分数为 6.75%
D.取 DE 两点间的剩余固体加入盐酸,均有气泡产生
13.(2015•遂宁)根据下列图示的探究过程,回答下列问题:
⑴图中操作①的名称 过滤 。
⑵图中固体中含有的物质(化学式) Fe、Ag 。
⑶写出步骤②发生反应的化学方程式 Fe + 2HCl=== FeCl2 + H2↑ 。
15.(2015•宜宾)(6 分)黄铜是 Zn 以主要添加元素的铜合金。黄铜渣中约含 Zn 7%、
ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂
质不溶于水、不参与反应):
已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
步骤Ⅰ中产生气体的化学方程式为 Zn + H2SO4 === ZnSO4 + H2↑ 。
(2) 溶液 A 中的金属阳离子有 Cu2+、Zn2+ (填化学式)
(3) 步骤Ⅰ、Ⅱ中均包含的操作名称为 过滤 ,此操作和步骤Ⅲ中的蒸发操作都要
用到的玻璃仪器是 玻璃棒 。 (4)溶液 A 小于 (填“大于”、“小于”或“等
于”)溶液 C 的质量。
5.(2015•黄冈)(6 分)王老师在某工厂废水处理池中提取一瓶含有 AgNO3、Cu(NO3)2 和 Al(NO3)3
的工业废水样品带回实验室。静置,取上层清液,加入锌粉,充分反应后过滤,得到滤液甲
和滤渣乙。请你和你的化学小组完成以下探究(不考虑杂质干扰)。
【提出问题】滤渣乙是什么?
【做出猜想】小明认为滤渣乙是银,小东认为滤渣乙是银和铜,小华认为滤渣乙是银、铜和
铝,你认为滤渣乙还可能是__银、铜和锌_。
【交流讨论】大家经过讨论后,认为小华的猜想错误,理由是__锌不和硝酸铝溶液反应____。
【实验探究】设计实验探究滤渣乙的成分,请填写下列空白:
实验步骤 现象 结论
实验 1:取滤渣乙加入盐酸 无气体产生 滤渣乙可能是__滤渣乙可能
是:银或银和铜_
实验 2:取滤液甲加入_氢氧
化钠、氢氧化钾(可溶液性碱
即可)__
无蓝色沉淀 滤渣乙一定是_滤渣乙一定
是:银和铜_
【反思交流】通过交流,大家认为在滤液甲中加入稀盐酸,当观察到__无变化、无明显现象
或无白色沉淀(任选其一)__,也能得出实验 1 的结论。
28.(2015•佛山)(7 分)某腐蚀印刷电路板的废液中含有 CuCl2 和 FeCl2,为了分析该废液的
组成,取 1 000 g 废液,设计如下实验方案进行探究:
实验过程中加入废铁屑的质量、析出 Cu 的质量的数据记录如下表:
废铁屑的质量/g 20 40 60 80
析出 Cu 的质量/g 12.8 25.6 32 32
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1 000 g 废液与足量废铁屑完全反应,析出 Cu 的质量为 32g 。
(2)废铁屑中单质 Fe 的质量分数为 56% 。
(3)计算 1 000 g 废液中 CuCl2 的质量分数。(写出计算过程,结果保留小数点后一位)6.75%
(4)1 000 g 废液中 FeCl2 的质量分数为 6.4% 。(结果保留小数点后一位)
21.(2015•南京)(11 分)小明在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性
气味,于是进行了探究。
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】(1)6H2SO4(浓)+2Fe Fe2(SO4)3+6 H2O +3SO2↑
(2)SO2 可使品红溶液的红色褪去。
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产物中可能有二氧化硫。
【实验探究】小明用图甲所示的装置进行实验,并将 E 中收集到的气体进行如图乙所示的爆
鸣实验。
请帮助小明完成下表:
A 中硫
酸浓度
实验现象 A 中生成气体
成分B 中品
红溶液
D 中品
红溶液
爆鸣实验
实验一 98% __________ 不褪色 无爆鸣声 只有 SO2
实验二 45% 稍有褪色 不褪色 有爆鸣声
实验三 25% __________ 不褪色 _________ 只有 H2
【实验结论】铁与不同浓度的硫酸溶液反应,生成的气体产物可能不同,当硫酸浓度达到足
够大时,生成的气体产物中有二氧化硫。
【义流反思】(1)写出实验三中铁与硫酸反应的化学方程式:_________________。
写出实验二中发生爆鸣反应的化学方程式:_____________________。
(2)实验一中 C 装置的作用是_________________________________。
【拓展延伸】小明又将 A 装置进行了如右图所示的改过。试分析增加的导管伸入液面以下
的原因是____________________________________________。
该导管所起的作用是_______________________________________。
答:【实验探究】褪色 (实验二)有 SO2 和 H2。(实验三)不褪色 有爆鸣声(或声音
很小)【义流反思】(1)H2SO4+ Fe= FeSO4 + H2↑、2H2+O2 2H2O (2)除去二氧化硫【拓
展延伸】形成液封,防止生成的气体逸出 平衡试管内外的压强,防止停止加热时液体倒
吸(其他合理答案均可)