- 1.06 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2015《金版新学案》高中化学总复习讲义:专题五第二单元 原电池和化学电源
考点一 原电池及其工作原理
1.概念
把化学能转化为电能的装置。
2.形成条件
(1)一看反应:看是否有能自发进行的氧化还原反应发生。
(2)二看两电极:一般是金属活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。
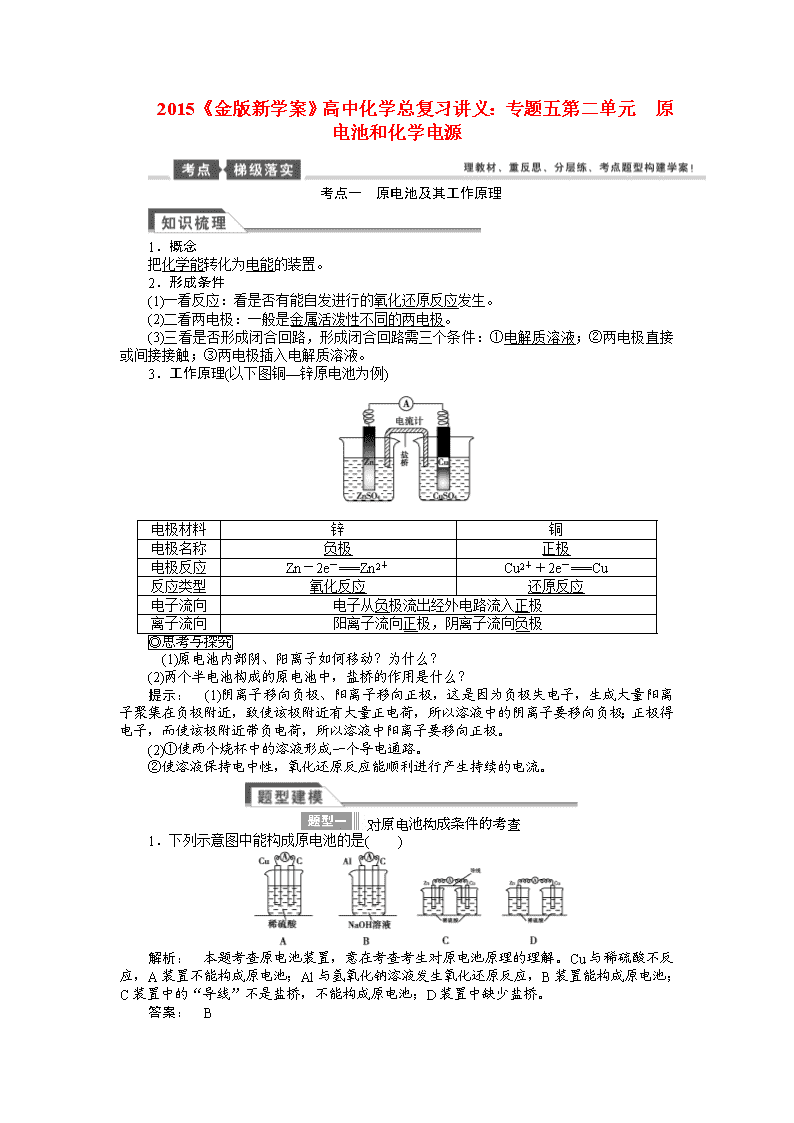
3.工作原理(以下图铜—锌原电池为例)
电极材料
锌
铜
电极名称
负极
正极
电极反应
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
氧化反应
还原反应
电子流向
电子从负极流出经外电路流入正极
离子流向
阳离子流向正极,阴离子流向负极
(1)原电池内部阴、阳离子如何移动?为什么?
(2)两个半电池构成的原电池中,盐桥的作用是什么?
提示: (1)阴离子移向负极、阳离子移向正极,这是因为负极失电子,生成大量阳离子聚集在负极附近,致使该极附近有大量正电荷,所以溶液中的阴离子要移向负极;正极得电子,而使该极附近带负电荷,所以溶液中阳离子要移向正极。
(2)①使两个烧杯中的溶液形成一个导电通路。
②使溶液保持电中性,氧化还原反应能顺利进行产生持续的电流。
1.下列示意图中能构成原电池的是( )
解析: 本题考查原电池装置,意在考查考生对原电池原理的理解。Cu与稀硫酸不反应,A装置不能构成原电池;Al与氢氧化钠溶液发生氧化还原反应,B装置能构成原电池;C装置中的“导线”不是盐桥,不能构成原电池;D装置中缺少盐桥。
答案: B
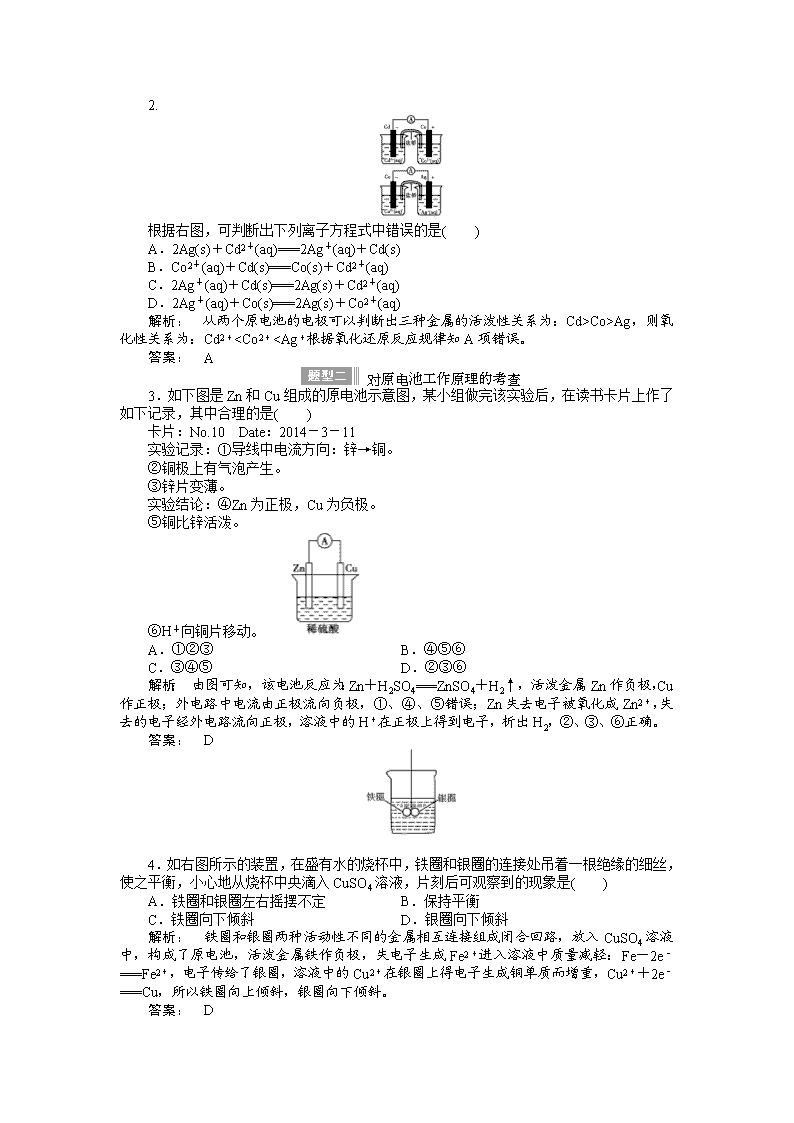
2.
根据右图,可判断出下列离子方程式中错误的是( )
A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq)
解析: 从两个原电池的电极可以判断出三种金属的活泼性关系为:Cd>Co>Ag,则氧化性关系为:Cd2+