- 207.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学培尖(10.22)
——无机推断题
无机推断题作为高考考查元素化合物知识的热点题型,主要特点有:①结构紧凑、文字表述少;②包含信息多、综合性强,思维能力要求高;③具有很高的区分度和很好的选拔功能。它不仅考查考生对元素及其化合物主干知识掌握的情况,更能考查考生思维的敏捷性、发散性、严密性和分析推理综合应用元素化合物知识的能力。重点考查氯、硫、氮、碳(硅)、钠、铝、铁等元素及其化合物性质。其主要考查形式可分为以下三类:选择型推断题、文字叙述型推断题、框图型推断题。其解题的基本思路是先“读”题(包括题干的提问),将“题眼”画记,从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向等多种思维方式,进行综合分析、推理,初步得出结论。再将结果放入原题检验,完全符合才算正确。
一、选择型推断题
已知A、B为单质,C为化合物:
能实现上述转化关系的是( )
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
二、文字叙述型推断题
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族。
(2)B与氢氧化钠溶液反应的化学方程式为:
(3)G与氯酸钠在酸性条件下反应可生成消毒杀
菌剂二氧化氯。该反应的氧化产物为 ,当生成2molClO2时,转移电子 mol。
(4)溶液F在空气中长期放置生成H的化学反应方程式为: 。
(5)H的溶液与稀硫酸反应产生的现象为
三、框图型推断题
下图表示各物质之间的转化关系。已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其它是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶
解于水,二者相遇会有白烟生成;
Ⅲ.B和C都是由一种金属与一种非金属元素
组成的化合物,其中非金属元素相同且质量分
数都是28%,组成B的金属元素原子核外的K
层和M层电子数相同。
请按要求填空:
⑴写出下列物质的电子式:A_______,X_______;
⑵工业上制取硝酸的反应有(反应①-⑧中选择,填写反应代号):_____________________;
⑶写出下列物质的化学式:B________,C________;
⑷反应④的化学方程式为:
__________________________________________。
⑸保持容器的温度和体积不变,在反应③刚好完全发生时,反应前后容器的压强之比为__________。
【练 习】
1、甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
2、A是一种常见的单质,B、C为中学常见的化合物,
A、B、C均含有元素X,它们有如下图所示的转化关
系(部分产物及反应条件已略去).下列推断正确的是
A.X元素为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
3、已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
⑴若A能使湿润的红色石蕊试纸变蓝;C为红棕色气
体。则A转化为B反应的化学方程式为
__________________________________________。⑵
若D是具有氧化性的单质,A元素属于短周期主族金
属元素,则C的电子式为___________。
⑶若D是金属,C溶液在贮存时应加入少量D,其理
由是(用必要的文字和离子方程式说明)
_________________________________________。
⑷若D是一种常见的温室气体;A是一种强电解质且
在水溶液中电离出的阴、阳离子均含有10个电子。
则B转化为C的离子方程式为
__________________________________________。
⑸若D为氯碱工业的主要产品,B具有两性,则C溶
液中除氢氧根外还存在的阴离子的化学式________。
⑹若A、B、C均为氧化物,D是一种黑色固态非金属
单质,则B分子的结构式为_______________。
⑺若A的体积分数为75%的溶液可用作医疗消毒剂;
B与新制氢氧化铜共热,有砖红色沉淀生成。则A生
成B的化学方程式为
__________________________________________。
4、生铁中一般含有由两种常见元素组成的化合物B,
其中金属元素与另一元素的质量比为14:1,它的含
量、形状、分布对生铁性能影响很大,使生铁硬而脆,
不宜进行机械加工。已知:
⑴E、F、H、I、P常温下为气体,H、I、P为单质,E
是一种红棕色气体。
⑵反应①②均为制备理想的绿色水处理剂Na2FeO4的
方法,其中反应①在生成Na2FeO4的同时还生成NaNO2
和H2O。
各物质之间的转化关系如下图所示(图中部分生成物
没有列出)。
请填写以下空白:
⑴写出F的电子式_________。
⑵B的化学式_________。
⑶反应③的离子方程式为____________________;
(4)反应①的化学方程式为___________________。
5.已知由短周期常见元素形成的纯净物A、B、C、D、
E、F、X转化关系如下图所示,B、X为单质,D常温
下为无色液体,A、B含同一种元素。(某些产物可能
略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式:
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用右图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学反应方程式
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物F,F的KSP=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP ,(填:增大、减小或不变),此时,组成不溶物F的阴离子在溶液中的浓度为
mol/L。
6、
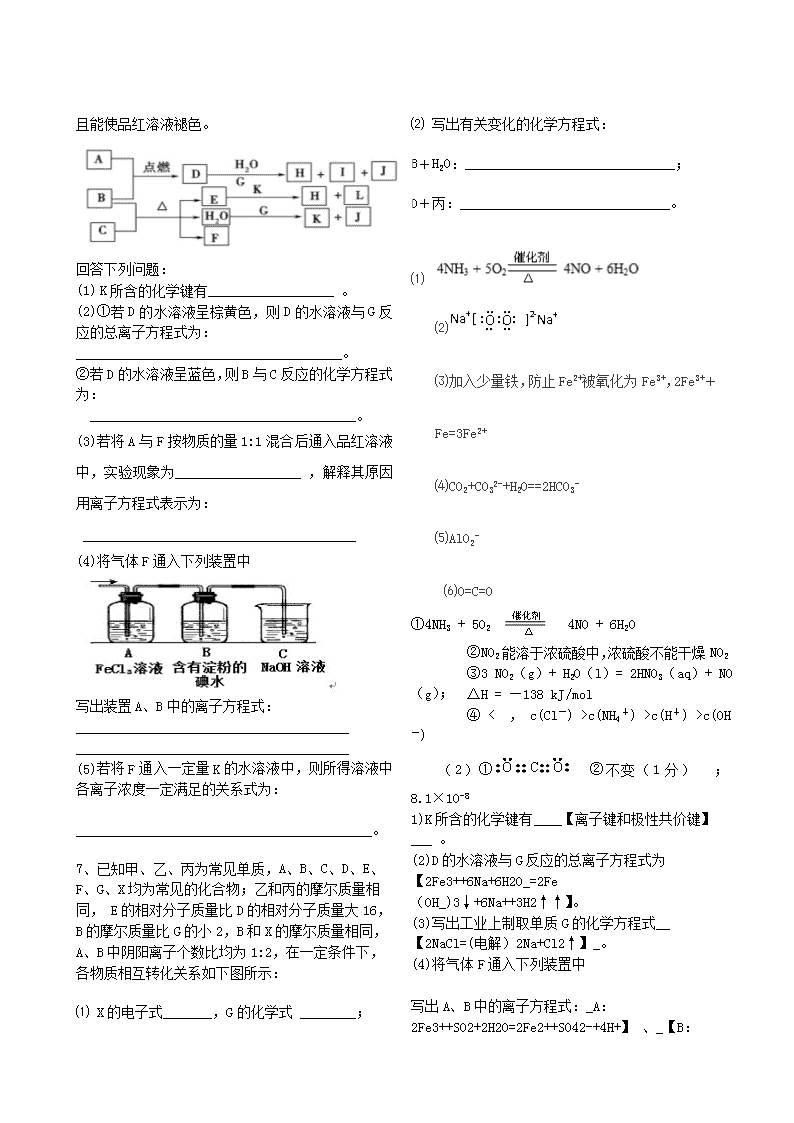
下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
回答下列问题:
(1) K所含的化学键有__________________ 。
(2)①若D的水溶液呈棕黄色,则D的水溶液与G反应的总离子方程式为:
______________________________________。
②若D的水溶液呈蓝色,则B与C反应的化学方程式为:
______________________________________。
(3)若将A与F按物质的量1:1混合后通入品红溶液中,实验现象为__________________ ,解释其原因用离子方程式表示为:
_______________________________________
(4)将气体F通入下列装置中
写出装置A、B中的离子方程式:
_______________________________________
_______________________________________
(5)若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的关系式为:
_____________________________________。
7、已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;乙和丙的摩尔质量相同, E的相对分子质量比D的相对分子质量大16,B的摩尔质量比G的小2,B和X的摩尔质量相同,A、B中阴阳离子个数比均为1:2,在一定条件下,各物质相互转化关系如下图所示:
⑴ X的电子式_______,G的化学式 ________;
⑵ 写出有关变化的化学方程式:
B+H2O:______________________________;
D+丙:______________________________。
⑴
⑵
⑶加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe=3Fe2+
⑷CO2+CO32-+H2O==2HCO3-
⑸AlO2-
⑹O=C=O
①4NH3 + 5O2 4NO + 6H2O
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = —138 kJ/mol
④ < , c(Cl-) >c(NH4+) >c(H+) >c(OH-)
(2)① ②不变(1分) ; 8.1×10-8
1)K所含的化学键有____【离子键和极性共价键】___ 。
(2)D的水溶液与G反应的总离子方程式为【2Fe3++6Na+6H2O_=2Fe(OH_)3↓+6Na++3H2↑↑】。
(3)写出工业上制取单质G的化学方程式__【2NaCl=(电解)2Na+Cl2↑】_。
(4)将气体F通入下列装置中
写出A、B中的离子方程式:_A:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+】
、_【B:I2+SO2+2H2O=2I-+SO42-+4H+】_。
(5)若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的关系式为 ________【C(Na+)+C(H+)=C(OH-)+2C(SO32-)+C(HSO3-)】___。
2答案⑴
⑵ ⑶加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe==3Fe2+ ⑷CO2+CO32-+H2O==2HCO3-⑸AlO2- ⑹O=C=O
3、①4NH3 + 5O2 4NO + 6H2O
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = —138 kJ/mol
④ < , c(Cl-) >c(NH4+) >c(H+) >c(OH-)
(2)①
②不变 ;8.1×10-8
2、答案⑴
⑵ ⑶加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe==3Fe2+ ⑷CO2+CO32-+H2O==2HCO3-⑸AlO2- ⑹O=C=O
3、①4NH3 + 5O2 4NO + 6H2O
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = —138 kJ/mol
④ < , c(Cl-) >c(NH4+) >c(H+) >c(OH-)
(2)①
②不变 ;8.1×10-8
2答案⑴
⑵ ⑶加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe==3Fe2+ ⑷CO2+CO32-+H2O==2HCO3-⑸AlO2- ⑹O=C=O
3、①4NH3 + 5O2 4NO + 6H2O
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = —138 kJ/mol
④ < , c(Cl-) >c(NH4+) >c(H+) >c(OH-)
(2)①
②不变 ;8.1×10-8
2、答案⑴
⑵ ⑶加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe==3Fe2+ ⑷CO2+CO32-+H2O==2HCO3-⑸AlO2- ⑹O=C=O
3、①4NH3 + 5O2 4NO + 6H2O
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = —138 kJ/mol
④ < , c(Cl-) >c(NH4+) >c(H+) >c(OH-)
(2)①
②不变 ;8.1×10-8