- 209.51 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业4 化学反应热的计算
时间:45分钟 满分:100分
一、选择题(每小题4分,共48分)
1.氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1;
4Al(s)+2O3(g)===2Al2O3(s) ΔH2;
3O2(g)===2O3(g) ΔH3。
则下列关系式正确的是( A )
A.ΔH1-ΔH2=ΔH3 B.ΔH1+ΔH2=ΔH3
C.ΔH2-ΔH1=ΔH3 D.ΔH2+ΔH1+ΔH3=0
解析:已知:①4Al(s)+3O2(g)===2Al2O3(s) ΔH1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH2
根据盖斯定律可知①-②即得到反应
3O2(g)===2O3(g) ΔH3
反应热ΔH3=ΔH1-ΔH2,答案选A。
2.碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?)2HI(g) ΔH=+9.48 kJ·mol-1
②H2(g)+I2(?)2HI(g) ΔH=-26.48 kJ·mol-1
下列判断正确的是( A )
A.①中的I2为固态,②中的I2为气态
B.①的反应物总能量比②的反应物总能量高
C.①的产物比②的产物热稳定性好
D.1 mol固态碘升华需吸热17 kJ
解析:两个反应中,只有碘的状态不同,其他都相同,前者是吸热反应,后者是放热反应,固态碘转化成气态碘是吸热过程,说明②中碘单质的能量比①中的高,即②中碘单质为气态,①中碘单质为固态,A正确;根据选项A的分析,②的反应物总能量大于①的反应物总能量,B错误;①和②的产物为相同状态下的HI,稳定性相同,C错误;①-②得I2(s)===I2(g) ΔH=+35.96 kJ·mol-1,D错误。
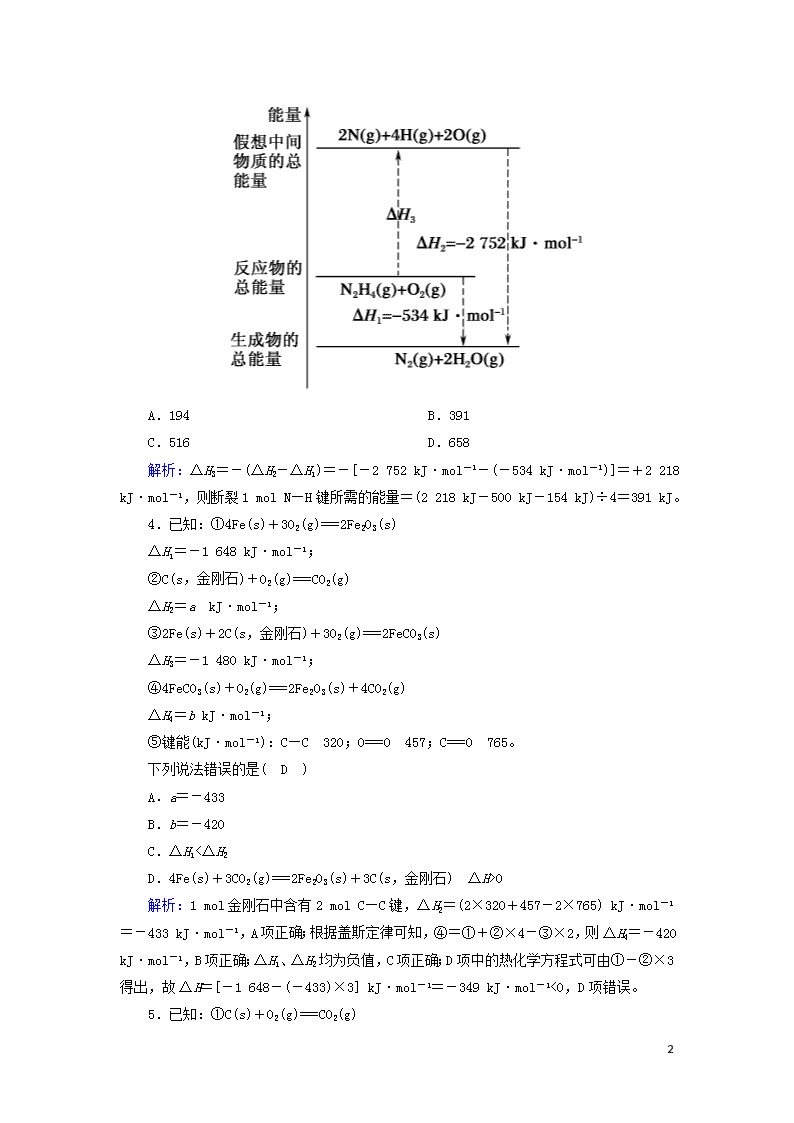
3.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol 化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是( B )
9
A.194 B.391
C.516 D.658
解析:ΔH3=-(ΔH2-ΔH1)=-[-2 752 kJ·mol-1-(-534 kJ·mol-1)]=+2 218 kJ·mol-1,则断裂1 mol N—H键所需的能量=(2 218 kJ-500 kJ-154 kJ)÷4=391 kJ。
4.已知:①4Fe(s)+3O2(g)===2Fe2O3(s)
ΔH1=-1 648 kJ·mol-1;
②C(s,金刚石)+O2(g)===CO2(g)
ΔH2=a kJ·mol-1;
③2Fe(s)+2C(s,金刚石)+3O2(g)===2FeCO3(s)
ΔH3=-1 480 kJ·mol-1;
④4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)
ΔH4=b kJ·mol-1;
⑤键能(kJ·mol-1):C—C 320;O===O 457;C===O 765。
下列说法错误的是( D )
A.a=-433
B.b=-420
C.ΔH1<ΔH2
D.4Fe(s)+3CO2(g)===2Fe2O3(s)+3C(s,金刚石) ΔH>0
解析:1 mol金刚石中含有2 mol C—C键,ΔH2=(2×320+457-2×765) kJ·mol-1=-433 kJ·mol-1,A项正确;根据盖斯定律可知,④=①+②×4-③×2,则ΔH4=-420 kJ·mol-1,B项正确;ΔH1、ΔH2均为负值,C项正确;D项中的热化学方程式可由①-②×3得出,故ΔH=[-1 648-(-433)×3] kJ·mol-1=-349 kJ·mol-1<0,D项错误。
5.已知:①C(s)+O2(g)===CO2(g)
9
ΔH1=-394 kJ·mol-1
②H2(g)+O2(g)===H2O(g)
ΔH2=-242 kJ·mol-1
③2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g)
ΔH3=-2 510 kJ·mol-1
④2C(s)+H2(g)===C2H2(g) ΔH4
下列说法正确的是( D )
A.反应①放出197 kJ的热量时,转移电子的数目为4NA
B.由反应②可知,1 mol水蒸气分解放出的热量为242 kJ
C.反应③是表示C2H2燃烧热的热化学方程式
D.ΔH4=2ΔH1+ΔH2-ΔH3
解析:反应①中每消耗1 mol C转移4 mol电子,放出394 kJ热量,A项错误;水蒸气分解需要吸收能量,B项错误;与燃烧热相对应的水是液态水且乙炔的化学计量数应该是1,C项错误;根据盖斯定律,由2×①+②-×③即可得出2C(s)+H2(g)===C2H2(g) ΔH4=2ΔH1+ΔH2-ΔH3,D项正确。
6.已知①C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q1 kJ·mol-1;②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1;③H2O(g)===H2O(l) ΔH3=-Q3 kJ·mol-1;若使23 g液体酒精完全燃烧,恢复到室温,则放出的热量(kJ)为( B )
A.Q1+Q2+Q3 B.0.5Q1-0.5Q2+1.5Q3
C.0.5(Q1+Q2+Q3) D.0.5Q1-1.5Q2+0.5Q3
解析:根据盖斯定律,由①-②+③×3,得C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-(Q1-Q2+3Q3) kJ·mol-1,所以23 g液体酒精完全燃烧,恢复到室温,放出的热量为(0.5Q1-0.5Q2+1.5Q3) kJ。
7.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( D )
A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②中,相同物质的量的甲烷发生反应,转移的电子数相同
9
D.反应②中,当4.48 L CH4反应完全时转移的电子的物质的量为1.60 mol
解析:①+②得2CH4(g)+4NO2(g)===2N2(g)+2CO2(g)+4H2O(g) ΔH=-1 160 kJ·mol-1+(-574 kJ·mol-1)=-1 734 kJ·mol-1,标准状况下4.48 L CH4的物质的量为0.2 mol,放出热量为173.4 kJ,A正确;气态水转化为液态水是放热的过程,反应中生成的水为液态时,放出热量更多,ΔH更小,故ΔH<-574 kJ·mol-1,B正确;反应①②中,相同物质的量的甲烷发生反应,转移的电子数相同,C正确;D中没有标明4.48 L CH4所处的状态,无法计算转移的电子的物质的量,D错误。
8.已知:①CH3OH(g)+O2(g)===CO2(g)+2H2O(g) ΔH=-a kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-b kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-c kJ·mol-1
则下列叙述正确的是( C )
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为b kJ·mol-1
C.2CH3OH(g)===2CH4(g)+O2(g)
ΔH=2(b-a) kJ·mol-1
D.若甲醇和甲烷的物质的量之比为12,其完全燃烧生成CO2和H2O(l)时放出的热量为Q kJ,则该混合物中甲醇的物质的量为 mol
解析:由气态水转化为液态水会放热,所以b
相关文档
- 2018-2019学年甘肃省临夏中学高二2021-07-057页
- 山东省泰安肥城市2020届高三适应性2021-07-0512页
- 2017-2018学年山西大学附属中学高2021-07-059页
- 2017-2018学年山东省寿光现代中学2021-07-0511页
- 2018-2019学年江西省南昌市八一中2021-07-059页
- 化学卷·2018届河北省武邑中学高二2021-07-056页
- 化学卷·2019届河南省洛阳市高二上2021-07-058页
- 2018-2019学年江苏省扬州中学高一2021-07-056页
- 江苏省2021届高三上学期新高考质量2021-07-0515页
- 山东专用2020届高考化学二轮复习专2021-07-0516页