- 1.14 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
- 1 -
汉中市 2021 届高三年级教学质量第一次检测考试
化 学
注意事项:
1.试题分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)。满分 100 分,考试时间 90 分钟。
2.答卷前,考生务必将自己的姓名、考号填涂在答题卡上。
3.选择题答案用 2B 铅笔把答题卡上对应题目的答案标号涂黑,非选择题用 0.5mm
黑色签字笔在答题卡上各题的答题区域内作答,超出答题区域的答案无效。
4.可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 C1 35.5 N i 59 Cu 64
第Ⅰ卷(选择题,共 42 分)
一、选择题(1~14 题,每小题 3 分,共 42 分。每小题只有一个选项符合题意)
1. 化学与工农业生产、日常生活、材料等有密切的联系,下列说法不正确的是( )
A. 华为公司自主研发的“麒麟 9000 芯片”需要以高纯度的硅为原料
B. 笔、墨、纸、砚为传统的文房四宝,上述物质中的毛笔与宣纸均含有机物
C. 新冠病毒可用次氯酸钠溶液或双氧水消毒,其消毒原理相同
D. 将生活垃圾露天焚烧,减少对人类生活的影响
【答案】D
【解析】
【详解】A.硅为良好的半导体,常用作芯片,故 A 正确;
B.毛笔的毛的主要成分是蛋白质,宣纸的主要成分为纤维素,均为有机物,故 B 正确;
C.新冠病毒可用次氯酸钠溶液或双氧水消毒,都是利用它们的强氧化性杀菌消毒,故 C 正确;
D.将生活垃圾露天焚烧,会产生有毒气体,危害人类健康,故 D 错误;
故答案为 D。
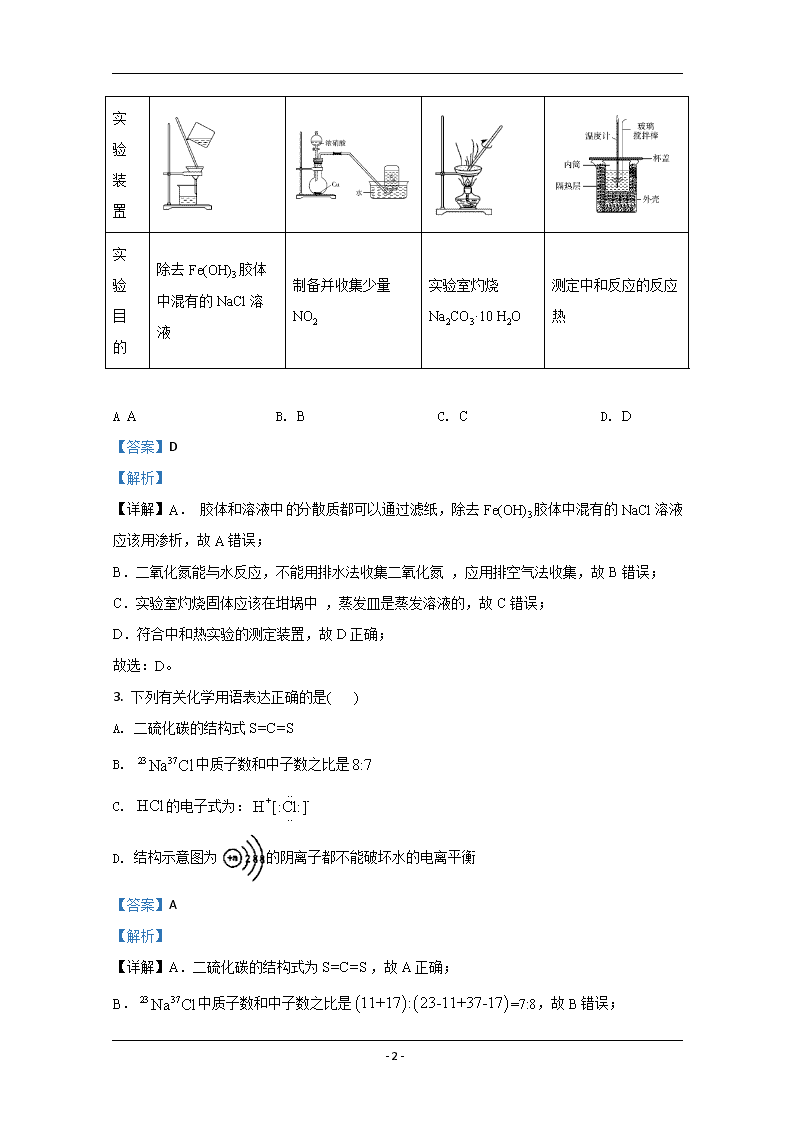
2. 用下列实验装置能达到相关实验目的的是( )
A B C D
- 2 -
实
验
装
置
实
验
目
的
除去 Fe(OH)3 胶体
中混有的 NaCl 溶液
制备并收集少量
NO2
实验室灼烧
Na2CO3·10 H2O
测定中和反应的反应
热
A A B. B C. C D. D
【答案】D
【解析】
【详解】A. 胶体和溶液中的分散质都可以通过滤纸,除去 Fe(OH)3 胶体中混有的 NaCl 溶液
应该用渗析,故 A 错误;
B.二氧化氮能与水反应,不能用排水法收集二氧化氮 ,应用排空气法收集,故 B 错误;
C.实验室灼烧固体应该在坩埚中 ,蒸发皿是蒸发溶液的,故 C 错误;
D.符合中和热实验的测定装置,故 D 正确;
故选:D。
3. 下列有关化学用语表达正确的是( )
A. 二硫化碳的结构式S=C=S
B. 23 37Na Cl 中质子数和中子数之比是8:7
C. HCl 的电子式为:
.
+ -
..
.
:Cl:H [ ]
D. 结构示意图为 的阴离子都不能破坏水的电离平衡
【答案】A
【解析】
【详解】A.二硫化碳的结构式为S=C=S ,故 A 正确;
B. 23 37Na Cl 中质子数和中子数之比是 11+17 : 23-11+37-17 =7:8,故 B 错误;
- 3 -
C. HCl 的电子式为 ,故 C 错误;
D.结构示意图为 的阴离子中,当 n=16 时,表示的是硫离子,硫化氢为弱酸,故硫离
子能够结合水电离的氢离子,破坏了水的电离平衡,故 D 错误;
故选 A。
4. 设 NA 为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 标准状况下,2.24L CCl4 含有的分子数为 0.1NA
B. 8g 甲醇中含有的 C-H 键数目为 NA
C. 22.4L(标况下)NO 与 0.5mol O2 混合充分反应,最后得到 NO2 分子数小于 NA
D. 常温下,pH=13 的 Ba(OH)2 溶液中含有 OH-数目为 0.1NA
【答案】C
【解析】
【详解】A.标准状况下 CCl4 为液体,2.24L CCl4 的物质的量不是 0.1mol,故 A 错误;
B.甲醇的结构简式是 CH3OH,8g 甲醇中含有的 C-H 键数目为 A
8g 3 N32g/mol
0.75NA,
故 B 错误;
C.22.4L(标况下)NO 的物质的量是 1mol,1mol NO 与 0.5mol O2 混合充分反应生成 1molNO2,
由于存在 2 2 42NO N O 平衡,最后得到 NO2 分子数小于 NA,故 C 正确;
D.常温下,pH=13 的 Ba(OH)2 溶液中 OH-的浓度是 0.1mol/L,没有溶液体积,不能计算 OH-
数目,故 D 错误;
选 C。
5. 在稀硫酸中加入铜粉,铜粉不溶解,再加入某物质 X,发现铜粉逐渐溶解,请问 X 不可能
是( )
A. Fe2(SO4)3 B. HCl C. H2O2 D. KNO3
【答案】B
【解析】
【详解】A.铜能和 Fe2(SO4)3 反应生成硫酸铜和硫酸亚铁,所以铜能在 Fe2(SO4)3 溶液中溶解 ,
- 4 -
故 A 不选;
B. 稀硫酸中加入铜粉,铜粉不溶解,再加入 HCl,铜仍然不溶解 ,故 B 选;
C.在稀硫酸中加入铜粉,铜粉不溶解,再加入 H2O2,过氧化氢具有氧化性,发现铜粉逐渐
溶解 ,故 C 不选;
D.向稀硫酸反应加入硝酸钾后,溶液中含有氢离子和硝酸根离子,所以相当于溶液中含有硝
酸,硝酸能和铜反应,所以加入硝酸钾后能溶解铜,故 D 不选;
故选:B。
6. 将 H2S 和空气的混合气体通入 FeCl3、FeCl2 和 CuCl2 的混合溶液中回收 S,其转化如图所示
(CuS 不溶于水)。下列说法错误的是( )
A. 过程①发生复分解反应,由弱酸反应得到强酸
B. 过程②中,发生反应的离子方程式为: S2-+2Fe3+=S+2Fe2+
C. 过程③中,标准状况下 11.2L O2 参加反应转移 2mol 电子
D. 在②中 Fe3+作氧化剂,在③中 Fe3+是氧化产物
【答案】B
【解析】
【详解】A.过程①发生的反应 2 2H S+CuCl =CuS +2HCl 是复分解反应,由硫化氢生成氯
化氢,由弱酸生成强酸,A 不选;
B.过程②中,Fe3+转化为 Fe2+,硫化铜是沉淀,不能拆成离子的形式,正确的离子方程式是
3+ 2+ 2+CuS+2Fe =Cu +S+2Fe ,故 B 选;
C.过程③中,标准状况下 11.2L O2 参加反应其物质的量是 11.2L
22.4L/mol =0.5mol,转移
0.5mol×2×2=2mol 电子,故 C 不选;
D.过程②中,Fe3+转化为 Fe2+,Fe3+作氧化剂,在③中 ,Fe2+转化为 Fe3+,Fe3+是氧化产物,
故 D 不选;
故选:B。
- 5 -
7. W、X、Y、Z 均为短周期元素,原子序数依次增加,W 原子的最外层电子数是次外层的 3
倍,X-、Y+具有相同的电子层结构,Z 的阴离子不能发生水解反应。下列说法正确的是( )
A. 原子半径:Y>Z>X>W
B. 简单氢化物的沸点:W>X>Z
C. 最高价氧化物对应的水化物的酸性:X>Z
D. W、X 可分别与 Y 形成化合物,其所含的化学键类型一定完全相同
【答案】B
【解析】
【分析】
W、X、Y、Z 均为短周期元素,原子序数依次增加,W 原子的最外层电子数是次外层的 3
倍,W 是 O 元素;Z 的阴离子不能发生水解反应,Z 是 Cl 元素,X-、Y+具有相同的电子层结
构,X 是 F 元素、Y 是 Na 元素。
【详解】A.电子层数越多半径越大,电子层数相同,质子数越多半径越小,原子半径:
Na>Cl>O>F,故 A 错误;
B.H2O、HF 分子间能形成氢键,水分子间氢键多,HCl 不能形成氢键,简单氢化物的沸点:
H2O>HF>HCl,故 B 正确;
C.F 元素没有正价,F 不能形成含氧酸,故 C 错误;
D.O 与 Na 能形成化合物 Na2O2、Na2O,Na2O2 含的化学键为离子键、共价键;Na2O 含的化
学键为离子键;F 与 Na 能形成化合物 NaF,所含的化学键为离子键;所以含的化学键类型不
一定完全相同,故 D 错误;
选 B。
8. 下列离子方程式书写正确的是( )
A. 将过量 SO2 气体通入 NaClO 溶液中:SO2+H2O+ClO-=SO 2-
4 +Cl-+2H+
B. 电解氯化镁溶液:2Cl-+2H2O
电解
2OH-+H2↑+Cl2↑
C. NaHCO3 溶液水解:HCO -
3 +H2O=CO 2-
3 +H3O+
D. 同浓度同体积的 NH4HSO4 溶液与 NaOH 溶液混合:NH +
4 +OH-=NH3·H2O
【答案】A
【解析】
- 6 -
【详解】A.将过量 SO2 气体通入 NaClO 溶液中,发生氧化还原反应,离子方程式为 SO2+
H2O+ClO-=SO 2-
4 +Cl-+2H+,故 A 正确;
B.电解氯化镁溶液生成的氢氧化镁是沉淀,离子方程式为 Mg2++2Cl-
+2H2O
电解
H2↑+Cl2↑+Mg(OH)2↓,故 B 错误;
C.NaHCO3 溶液水解生成碳酸和氢氧根,离子方程式为 HCO -
3 +H2O=H2CO3+OH-,故 C 错
误;
D.由于 NH4HSO4 电离的 H+、NH +
4 中 H+结合 OH-的能力强于 NH +
4 ,所以同浓度同体积的
NH4HSO4 溶液与 NaOH 溶液混合,反应的离子方程式为 H++OH-=H2O,故 D 错误;
故答案为 A。
9. T K 时,向 2.0L 恒容密闭容器中充入 0.10mol COCl2,发生反应 COCl2(g) Cl2(g)+
CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的
是( )
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.030 0.039 0.040 0.040
A. 反应在前 2s 的平均速率 v(COCl2)=0.015mol·L-1·s-1
B. 平衡后,温度不变再充入一定量 COCl2,该反应的化学平衡常数减小
C. 保持其他条件不变,升高温度,若新平衡时 c(Cl2)=0.038 mol·L-1,则反应的△H<0
D. 平衡后向上述容器中再充入 0.10 mol COCl2,平衡正向移动,COCl2 的转化率减小
【答案】D
【解析】
【详解】A.根据表格数据可知,前 2s 生成 Cl20.03mol,由方程式可知,消耗 0.03molCOCl2,
则 v(COCl2) -1 -1
0.03mol
2L 0.0075mol L s2s
,A 错误;
B.平衡常数只与温度有关,温度不变时,平衡常数不发生改变,B 错误;
C.根据表格数据可知,反应达到平衡时,c(Cl2)=0.020 mol·L-1,保持其他条件不变,升高温
度,若新平衡时 c(Cl2)=0.038 mol·L-1,说明平衡正向移动,则反应为吸热反应,即△H>0,C
- 7 -
错误;
D.平衡后向上述容器中再充入 0.10 mol COCl2,增大了反应物的浓度,平衡正向移动,但根
据勒夏特列原理原理,只能削弱不能抵消,COCl2 增加的更多,所以 COCl2 的转化率减小,D
正确;
答案选 D。
10. 分子式为 C7H14O 的有机物,含有六元环状结构且能与 Na 反应放出 H2 的化合物,其可能
的结构有( )
A. 5 种 B. 4 种 C. 3 种 D. 2 种
【答案】A
【解析】
【详解】分子式为 C7H14O 的有机物,不饱和度为 1,含有六元环状结构且能与 Na 反应放出
H2,说明含有 1 个羟基,结构为 、 、 、 、 ,故
选 A。
11. 由下列实验操作和现象得出的结论不正确的是( )
选
项
实验操作 实验现象 结论
A 向 Co2O3 中滴加浓盐酸
产生黄绿
色气体
氧化性: Co2O3 >
Cl2
B
白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一
段时间后滴加几滴 K3[Fe(CN)6]溶液
无明显现
象
锌对铁依然具有保
护作用
C 将铁片投入浓硫酸中
无明显变
化
常温下铁不与浓硫
酸反应
D
将 10mL 2mol/L 的 KI 溶液与 1mL 1mol/L FeCl3 溶液
混合充分反应后滴加 KSCN 溶液
溶液颜色
变红
KI 与 FeCl3 的反应
具有可逆性
A. A B. B C. C D. D
【答案】C
- 8 -
【解析】
【详解】A. 发生氧化还原反应生成氯气,Co 元素的化合价降低,由氧化剂的氧化性大于氧
化产物的氧化性可知,氧化性:Co2O3 > Cl2,故 A 正确;
B. 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,构成原电池,Zn 为负极,发生氧化反
应,Fe 为正极被保护,故 B 正确;
C. 常温下铁与浓硫酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,并不是不反应,
故 C 错误;
D. KI 过量,由现象可知还反应后存在铁离子,则 KI 与 FeCl3 的反应具有可逆性,故 D 正确;
故选:C。
12. 我国科学家研发了一种水系可逆 Zn—CO2 电池,电池工作时,复合膜(由 a、b 膜复合而成)
层间的 H2O 解离成 H+和 OH- ,在外加电场中可透过相应的离子膜定向移动。当闭合 K1 时,
Zn—CO2 电池工作原理如图所示。下列说法不正确的是( )
A. 闭合 K1 时,H+通过 a 膜向 Pd 电极方向移动
B. 闭合 K1 时,Zn 表面的电极反应式为 Zn+4OH--2e- = Zn(OH) 2-
4
C. 闭合 K2 时,Zn 电极与直流电源正极相连
D. 闭合 K2 时,在 Pd 电极上有 CO2 生成
【答案】C
【解析】
【详解】A.闭合 K1 时,形成原电池,锌为负极,Pd 电极是正极 ,氢离子是阳离子,向正极
移动,故 A 不选;
B.闭合 K1 时,形成原电池,锌为负极,Zn 表面的电极反应式为 Zn+4OH--2e- = Zn(OH) 2-
4 ,
符合原电池原理,电荷守恒,原子守恒,故 B 不选;
C.闭合 K2 时,形成电解池,Zn 电极发生还原反应做阴极,应与直流电源负极相连,C 选;
- 9 -
D.闭合 K2 时,Pd 电极是阳极,发生氧化反应, HCOOH 氧化生成 CO2,故 D 不选;
故选:C。
13. 工业以软锰矿(主要成分是 MnO2,含有 SiO2、Fe2O3 等少量杂质)为主要原料制备高性能的
磁性材料碳酸锰(MnCO3),其工业流程如图。下列说法错误的是( )
A. 浸锰过程中 Fe2O3 与 SO2 反应的离子方程式为: Fe2O3+SO2+2H+=2Fe2++SO 2-
4 +H2O
B. 过滤 I 所得滤液中主要存在的金属阳离子为 Mn2+、Fe3+和 Fe2+
C. 滤渣 II 的主要成分含有 Fe(OH)3
D. 过滤 II 所得的滤液中加入 NH4HCO3 溶液发生反应的主要离子方程式为: Mn2++
2HCO -
3 =MnCO3↓+CO2↑+H2O
【答案】B
【解析】
【分析】
浸锰过程通入过量的 SO2,将 Mn4+和 Fe3+还原成 Mn2+和 Fe2+,过滤Ⅰ所得滤渣为 SiO2,加入
MnO2 氧化,此时溶液中可以被氧化的物质有 Fe2+和未反应的 SO2,调 pH 是为了将上一步氧
化生成的 Fe3+沉淀下来与 Mn2+分离,加入 NH4HCO3 溶液将 Mn2+沉淀下来,再经过一系列步
骤可得到纯的 MnCO3。
【详解】A.根据上述分析可知,浸锰过程通入过量的 SO2,将 Mn4+和 Fe3+还原成 Mn2+和 Fe2+,
反应的离子方程式为:Fe2O3+SO2+2H+=2Fe2++SO 2-
4 +H2O,A 正确;
B.过量的 SO2,将 Mn4+和 Fe3+还原成 Mn2+和 Fe2+,因此过滤 I 所得滤液中主要存在的金属阳
离子为 Mn2+和 Fe2+,不会含有 Fe3+,B 错误;
C.调 pH=3.7,将 Fe3+转化为氢氧化铁沉淀,过滤,滤渣Ⅱ的主要成分含有 Fe(OH)3,C 正确;
D.滤液为硫酸锰溶液,向滤液种加入适量 NH4HCO3 溶液,生成 MnCO3 沉淀,同时二氧化碳
生成,发生的反应为:Mn2++2HCO -
3 =MnCO3↓+CO2↑+H2O,D 正确;
答案选 B。
- 10 -
14. 常温下,用 0.1 mol·L-1 NaOH 溶液滴定 10 mL 0.1 mol·L-1 HA 溶液的滴定曲线如图所示,
下列说法不正确的是( )
A. a≈3,说明 HA 属于弱酸
B. 水的电离程度:d 点>e 点
C. c 点溶液中:c(Na+)=c(A-)+c(HA)
D. b 点溶液中粒子浓度大小: c(A-)>c(Na+)>c(H+)>c(OH- )
【答案】C
【解析】
【详解】A. c(HA)=0.1mol/L,若为强酸,氢离子浓度应为 c(H+)=0.1mol/L,溶液的 pH=3,
c(H+)=0.001mol/L,说明 HA 电离程度较小,HA 属于弱酸,故 A 不选;
B. 酸或碱抑制水电离,弱离子促进水电离,d 点溶质为 NaA,促进水电离,e 点溶质为 NaA
和 NaOH,NaOH 抑制水电离,所以水电离程度:d 点>e 点,故 B 不选;
C. c 点溶液显中性,由电荷守恒 + + - -c(Na )+c(H )=c(A )+c(OH ) 得:c(Na+)=c(A-) ,故 C 选;
D. b 点溶液中溶质为等物质的量浓度的 HA 和 NaA,溶液 pH<7,溶液呈酸性,说明 HA 电
离程度大于 A−水解程度,所以 c(A−)>c(HA),钠离子不水解,且 HA 电离程度和 A−水解程度
都较小,所以 c(A-)>c(Na+)>c(H+)>c(OH-),故 D 不选;
故选:C。
第Ⅱ卷(非选择题,共 58 分)
二、必做题(15~17 题,共 43 分)
15. NaClO2 是一种重要的杀菌消毒剂,也常用来漂白织物。实验室模拟生产 NaClO2 的一种工
艺如下:
- 11 -
己知:①ClO2 是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空
气等进行稀释,同时避免光照、震动等。②NaClO2 饱和溶液在温度低于 38℃时析出的晶体是
NaClO2·3H2O,高于 38℃时析出的晶体是 NaClO2,高于 60℃时 NaClO2 分解成 NaClO3 和 NaCl。
回答下列问题:
(1)写出实验室制取 SO2 的化学方程式___________;上述流程中“反应”的离子方程式为
___________; 尾气吸收时 H2O2 的作用是___________(填氧化剂或还原剂)。
(2)最近科学家又在“反应”步骤的基础上研究出用 H2C2O4 代替 SO2 制备 ClO2 的新方法,该方法
的化学方程式为 H2C2O4+2NaClO3+H2SO4=Na2SO4+2ClO2↑+2CO2↑+2 H2O 该新方法最
突出的优点是___________。
(3)获得产品 NaClO2 的“操作”包括以下步骤:①减压,55℃蒸发结晶;②趁热过滤;③用 38℃~
60℃的温水洗涤;④60℃以下___________,得到产品。
(4)为了测定产品 NaClO2 的纯度,取上述所得产品 7.5g 溶于水配成 1L 溶液,取出 20.00mL 溶
液于锥形瓶中,再加入足量酸化的 KI 溶液,充分反应后(ClO -
2 被还原为 Cl-,杂质不参加反应),
加入 2~3 滴淀粉溶液,用 0.25 mol·L-1 Na2S2O3 标准液滴定,达到滴定终点时用去标准液
24.00mL,计算产品 NaClO2 的纯度___________。 (提示:2 Na2S2O3+I2=Na2S4O6+2Na I)
(5)NaClO2 溶液中存在 ClO2、HClO2、ClO -
2 、Cl-四种含氯微粒。经测定 25℃各含氯微粒浓度
随 pH 的变化情况如图所示(Cl-没有画出)。
①酸性条件下 NaClO2 溶液中存在 Cl-的原因是___________(用离子方程式解释)。
②pH=5 时,NaClO2 溶液中 ClO2、HClO2、ClO -
2 、Cl-四种含氯微粒的浓度由大到小的顺序是
- 12 -
___________。
【答案】 (1). Na2SO3+H2SO4=Na2SO4+SO2↑+H2O (2). 2ClO -
3 +SO2=SO 2-
4 +2ClO2↑
(3). 还原剂 (4). 反应生成 CO2 对 ClO2 起稀释作用,防止浓度过大时分解爆炸 (5). 干
燥 (6). 90.5% (7). 5ClO -
2 +4H+=4ClO2+Cl-+2H2O 或 5 HClO2=4ClO2+Cl-+2H2O+
H+ (8). c(HClO2)> c(ClO -
2 )> c(ClO2)> c(Cl-)
【解析】
【分析】
由制备流程可知,NaClO3 和 SO2 在 H2SO4 酸化条件下生成 ClO2,其中 NaClO3 是氧化剂,
回收产物为 NaHSO4,说明生成硫酸氢钠,且产生 ClO2,根据电子守恒可知,此反应的化学
方程式为 2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2,选择 NaOH 除去食盐水中的 Mg2+,选择
碳酸钠除去食盐水中的 Ca2+,然后电解装置中阴极 ClO2 得电子生成 ClO2-,阳极 Cl-失电子生
成 Cl2,含过氧化氢的氢氧化钠溶液吸收 ClO2,产物为 ClO2-,最后 NaClO2 溶液结晶、干燥
得到产品,以此解答该题。
【详解】(1) 实验室制取 SO2 的化学方程式 Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,上述流程
中“反应”中通入的是二氧化硫、亚氯酸钠,其离子方程式为 2ClO -
3 +SO2=SO 2-
4 +2ClO2↑,尾
气吸收时 H2O2 的作用是还原剂;
(2)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水,
该反应为 H2C2O4+2NaClO3+H2SO4=Na2SO4+2ClO2↑+2CO2↑+2 H2O,其优点是只生成一
种可溶性盐,此法提高了生产及储存、运输的安全性,原因是反应过程产生的 CO2 气体对 ClO2
起稀释作用,防止浓度过大时分解爆炸,;
(3)获得产品 NaClO2,由题给信息可知应用 38℃∼60℃的温水洗涤,60℃以下干燥;
(4)NaClO2 与足量酸化的 KI 溶液,反应为: - - + -
2 2 2ClO +4I +4H =2H O+2I +Cl ,2 Na2S2O3
+I2=Na2S4O6+2Na I 令样品中 NaClO2 的物质的量 x,则:
- 2-
2 2 2
3
3
-
1mol 4mol
x 24 10 0.2
ClO 2I 4S
5
O
解得:x=1.5×10−3mol,
20mL 样品中 m(NaClO2)=0.0015mol×90.5g/mol,原样品中 NaClO2 的质量分数为:
- 13 -
0.0015mol 90.5g/mo 100%20 ×71
l
.5g000
=90.5%;
(5)①酸性溶液中 NaClO2 发生歧化反应生成 NaCl 和 ClO2,离子方程式 5ClO -
2 +4H+=4ClO2+
Cl-+2H2O 或 5 HClO2=4ClO2+Cl-+2H2O+ H+;
②由图象可知,pH=5 时,c(HClO2)> c(ClO -
2 )> c(ClO2),又因为酸性条件下可发生 5ClO -
2 +
4H+=4ClO2+Cl-+2H2O,则 c(ClO2)> c(Cl-),所以 c(HClO2)> c(ClO -
2 )> c(ClO2)> c(Cl-)。
16. 三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化、塑胶助剂等行业。某兴趣
小组用 O2 直接氧化 PCl3 制备 POCl3,实验装置设计如图:
有关物质的部分性质如下表:
物质 熔点/℃ 沸点/℃ 其它性质
PCl3 -112 75.5 遇水生成 H3PO3 和 HCl,遇 O2 生成 POCl3
POCl3 2 105.3 遇水生成 H3PO4 和 HCl,能溶于 PCl3
回答下列问题:
(1)装置 C 中反应器的名称是___________。
(2)装置 B 中试剂为___________;装置 B 的作用是___________。
(3)装置 A 中发生反应的化学方程式为___________;装置 C 中制备 POCl3 的化学方程式为
___________。
(4)a 装置的作用是___________。
(5)通过佛尔哈德法可以测定三氯氧磷产品中 Cl 元素的含量,实验步骤如下:
Ⅰ.取 m 克产品于锥形瓶中,加入足量 NaOH 溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入 0.1000 mol·L-1 的 AgNO3 溶液 50.00 mL,使 Cl-完全沉淀;
- 14 -
Ⅲ.向其中加入 2 mL 硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用 c mol·L-1 NH4SCN 溶液滴定过量 Ag+至终点,记下所用体积为 VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是___________。
A.酚酞 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②Cl 元素的质量分数为(列出算式)___________。
③若取消步骤Ⅲ,会使步骤Ⅳ中出现两种沉淀共存 ,此时 c(Cl-)∶c(SCN-)=___________;该
反应使测定结果___________(填“偏大”“偏小”或“不变”)。
【答案】 (1). 三颈烧瓶或三口烧瓶 (2). 浓 H2SO4 (3). 平衡气压,干燥氧气,观察
气体流速 (4). 2H2O2
2MnO
2H2O+O2↑或 2Na2O2+2H2O=4NaOH+O2 ↑ (5). 2PCl3+O2
=2POCl3 (6). 冷凝回流 (7). B (8).[(5-cV)×35.5×10-3/m]×100% 或[3.55(5-cV)/m]%
(9). 160∶1 或 160 (10). 偏小
【解析】
【分析】
根据实验目的可知,装置 A 是氧气的发生装置,取固体与液体不加热制备气体装置,可以为
H2O2 在 MnO2 催化作用下分解生成氧气,也可以是过氧化钠与水反应,通过加入液体的量,
可以控制产生氧气的速率,氧气中含有水蒸气,可以用浓硫酸除去,所以 B 装置中盛放浓硫
酸,装置 B 中有长颈漏斗,可以平衡装置内外的压强,起安全瓶的作用,纯净的氧气与三氯
化磷在 C 中反应生成 POCl3,为了控制反应速率且要防止三氯化磷挥发,反应的温度不宜太高,
所以装置 C 用水浴加热,为防止 POCl3 挥发,用冷凝管 a 进行冷凝回流,POCl3 遇水剧烈水解
为 H3PO4 和 HCl,所以为防止空气中水蒸汽进入装置,同时吸收尾气,所以在装置的最后连有
碱石灰的干燥管,据此分析解答。
【详解】(1)根据装置图可知,装置 C 中盛装 PCl3 的反应器为三颈烧瓶,故答案为:三颈烧瓶;
(2)装置 B 中装有浓硫酸,可作干燥剂,另外气体通过液体时可观察到气泡,则装置 B 的作用
是观察 O2 的流速、平衡气压、干燥氧气,故答案为:浓硫酸;干燥氧气、观察氧气流速、平
衡气压等;
(3)装置 A 是氧气的发生装置,为固体与液体不加热制备气体的装置,可以为 H2O2 在 MnO2
催化分解生成氧气,也可以是过氧化钠与水反应,反应的化学方程式为:
- 15 -
2H2O2
2MnO
2H2O+O2↑或 2Na2O2+2H2O=4NaOH+O2↑;根据装置图可知,装置 C 中氧气氧化
PCl3 生成 POCl3,根据原子守恒,反应的化学方程式为 2PCl3+O2=2POCl3,故答案为:
2H2O2
2MnO
2H2O+O2↑或 2Na2O2+2H2O=4NaOH+O2↑;2PCl3+O2=2POCl3;
(4)仪器 a 为球形冷凝管,起冷凝回流的作用,故答案为:冷凝回流;
(5)①用 c mol•L-1NH4SCN 溶液滴定过量 Ag+至终点,当滴定达到终点时 NH4SCN 过量,加
NH4Fe(SO4)2 作指示剂,Fe3+与 SCN-反应溶液会变红色,半分钟内不褪色,即可确定滴定终点,
故答案为:B;
②用 c mol/LNH4SCN 溶液滴定过量 Ag+至终点,记下所用体积 VmL,则过量 Ag+的物质的量
为 cV×10-3mol,与 Cl-反应的 Ag+的物质的量为 0.1000mol/L×0.05L-cV×10-3mol=(5-cV)×10-3mol,
Cl 元素的质量分数为 35 cV 10 mol 35.5g/mol
mg
×100%= 35 cV 35.5 10
m
×100%,
故答案为: 35 cV 35.5 10
m
×100%;
③若取消步骤 III,会使步骤 IV 中出现两种沉淀共存 ,此时 c(Cl-)∶c(SCN-)=
Ksp(AgCl)∶Ksp(AgSCN)=3.2×10-10∶2×10-12 =160∶1;若无此操作,NH4SCN 与 AgCl 反应生成
AgSCN 沉淀,则滴定时消耗的 NH4SCN 标准液的体积偏多,即银离子的物质的量偏大,则与
氯离子反应的银离子的物质的量偏小,所以测得的氯离子的质量分数偏小,故答案为:160∶1;
偏小。
【点睛】明确实验原理及实验基本操作方法是解本题关键。本题的易错点为(5)③中的误差分
析,要注意滴定原理的理解。
17. 还原法处理氮的氧化物是环境科学研究的热点课题。
Ⅰ.氢气还原法。H2 还原 NO 发生的反应为:2NO(g)+2H2(g) N2(g)+2H2O(g)。
(1)已知几种化学键的键能数据如下:
化学键 H-H NO 中的共价键 N≡N H-O
键能(kJ·mol-1) 436 630 946 463
2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH=___________kJ·mol-1。
- 16 -
(2)2NO(g)+2H2(g) N2(g)+2H2O(g) 的反应速率表达式为v=kc2(NO)·c(H2)(k 是速率常数,
只与温度有关)。科学研究发现上述反应分两步进行:
反应 1:2NO(g)+H2(g) N2(g)+H2O2(g);
反应 2:H2O2(g)+H2(g) 2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,反应较慢的是___________(填
“反应 l”或 “反应 2”)。对总反应速率的影响程度 c(NO)___________c(H2)(填“>”“<”
或“=”)。
Ⅱ.NH3 还原法。在恒容密闭容器中充入 NH3 和 NO2,在一定温度下发生反应: 8NH3(g)+
6NO2(g) 7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是_____(填字母)。
A.混合气体密度保持不变 B.NO2 和 NH3 的消耗速率之比为 3∶4
C.混合气体颜色不变 D.混合气体压强保持不变
Ⅲ. CO 还原法。
利用高效催化剂处理汽车尾气中的 NO 和 CO,发生反应:2CO(g)+2NO(g) N2(g)+
2CO2(g) ΔH,在 2 L 恒容密闭容器中充入 1 mol CO 和 1 mol NO,测得 NO 的转化率与温度、
时间的关系如图所示:
(4)下列说法正确的是___________(填字母)。
A.ΔH<0
B.上述反应一定能自发进行
C.增大 NO 的浓度,反应物的转化率增大
D.温度为 T1、T2 时的平衡常数分别为 K1、K2,则 K1<K2
(5)T2 温度下,0~10 min 内用 CO 表示的平均反应速率 v(CO)=___________ mol·L-1·min-1;T1
温度下,上述反应的平衡常数 K1=___________ L·mol-1。
- 17 -
(6)T1 温度下,向平衡后的容器内再加入 1 mol CO 和 1 mol NO,则再次达平衡时 NO 的转化率
______(填“增大”“减小”或“不变”)。
【答案】 (1). -666 (2). 反应 1 (3). > (4). CD (5). AD (6). 0.04 (7). 2
(8). 增大
【解析】
【详解】Ⅰ.(1) ΔH=反应物的键能总和-生成物的键能总和=2×436 kJ·mol-1+2×630 kJ·mol-1-946
kJ·mol-1-4×463 kJ·mol-1=-666 kJ·mol-1。
(2)总反应速率由反应较慢的一步决定,由反应的反应速率表达式为 v=kc2(NO)·c(H2),可知,
反应 1 速率较慢;c(NO)的幂为 2,所以 c(NO)对总反应速率的影响大于 c(H2)。
Ⅱ.(3) A.反应前后气体的总质量和总体积不变,故混合气体密度始终保持不变,无法说明
反应达到平衡,故 A 错误;
B.不论是否平衡,NO2 和 NH3 的消耗速率之比都为 3∶4,无法说明反应达到平衡,故 B 错
误;
C.混合气体颜色不变,说明 NO2 的浓度不再变化,说明反应达到平衡状态,故 C 正确;
D.反应为气体体积增大的反应,混合气体压强保持不变,说明反应达到平衡状态,故 D 正确;
故答案为 CD。
Ⅲ.(4) A.由图像可知,T1 时先达到平衡,所以 T1>T2,温度升高 NO 转化率减小,说明反应
为放热反应,ΔH<0,故 A 正确;
B.反应 2CO(g)+2NO(g) N2(g)+2CO2(g)的ΔH<0,ΔS<0,只有在低温条件下
ΔH-TΔS=ΔG<0,才能自发进行,故 B 错误;
C.增大 NO 的浓度,平衡右移,但 NO 的转化率减小,故 C 错误;
D.温度为 T1、T2 时的平衡常数分别为 K1、K2,因为 T1>T2,且反应为放热反应,则 K1<K2,
故 D 正确;
故答案为 AD。
(5) T2 温度下,0~10 min 内,NO 的转化率为 80%,则 CO 的转化率也为 80%,Δn(CO)=0.8 mol,
则 v(CO)=
CO 0.8
2L 2L
10min 10
n mol
min
=0.04 mol·L-1·min-1;T1 温度下,NO 的转化率为 50%,则平
衡时 c(CO)=0.25 mol/L,c(NO)=0.25 mol/L,c(N2)=0.125 mol/L,c(CO2)=0.25 mol/L,上述反
- 18 -
应的平衡常数 K1=
22
2 2
2 22 2
N CO 0.125 / L 0.25 / L
CO NO 0.25 / L 0.25 / L
c c mol mol
c c mol mol
=2 L·mol-1。
(6)恒容条件下,T1 温度下,向平衡后的容器内再加入 1 mol CO 和 1 mol NO,相当于增大压强,
平衡向气体体积减小的方向即正方向移动,则再次达平衡时 NO 的转化率增大。
三、选做题(请从 18、19 题中任选一题做在答题卷上,15 分)
【选修 3:物质结构与性质】
18. 许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用___________上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的轨道表示式: ,该表示式违背了
___________; CH +
3 、-CH3、CH -
3 都是重要的有机反应中间体。CH +
3 的空间构型为_______;
CH -
3 中 C 原子成键的杂化方式为_____。
(3)34 号元素硒的基态原子的价层电子排布式为___________,第四周期中,与硒原子未成对电
子数相同的金属元素有___________种。
(4)Fe3O4 晶体中,O2- 围成正四面体空隙(1、3、6、7 号氧围成)和正八面体空隙(3、6、7、8、9、
12 号氧围成),Fe3O4 中有一半的 Fe3+填充在正四面体空隙中,Fe2+和另一半 Fe3+填充在正八
面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为___________,有___________%
的正八面体空隙没有填充阳离子。
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子 A 的坐标参数为(0,1,0)。
①原子 B 的坐标参数为___________;
- 19 -
②若该晶体密度为 d g·cm-3,则铜镍原子间最短距离为___________。
【答案】 (1). 原子光谱 (2). 洪特规则 (3). 平面三角形 (4). sp3 (5). 4s24p4
(6). 3 (7). 2∶1 (8). 50 (9). 1 1( ,0, )2 2 (10). 3
A
2 251 cm2 dN
【解析】
【详解】(1)光谱分析是利用原子光谱上的特征谱线来鉴定元素,所以现代化学中,常利用原
子光谱上的特征谱线来鉴定元素;
(2)洪特规则是原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨
道,且自旋状态相同,而该同学画出基态碳原子的轨道表示式: ,该表
示式违背了洪特规则;CH +
3 中心原子的价层电子对数为:3+ 4 1 3 1
2
=3,为 sp2 杂化,没
有孤电子对,为平面三角形, CH -
3 中心原子的价层电子对数为:3+ 4 1 3 1
2
=4,C 原子成
键的杂化方式为 sp3;
(3) 34 号元素硒的基态原子的价层电子排布式为 4s24p4;硒有 2 个未成对电子,第四周期中,
与硒原子未成对电子数相同的金属元素有钛、镍、锗三种;
(4)由 1、3、6、7 号 O2- 围成正四面体空隙有 8 个,面心位置 6 个 O2- 即 3、6、7、8、9、12
号 O2- 围成正八面体空隙,将晶胞补全可知共用一条棱和四个面心与该棱顶点 O2- 也围成正八
面体,而这样的正八面体为 4 个晶胞共有,晶胞中正八面体数目为 1+12× 1
4 =4,则晶体中正
四面体空隙数与正八面体空隙数之比为 8∶4=2∶1;Fe3O4 中有一半的 Fe3+填充在正四面体空
隙中,Fe2+和另一半 Fe3+填充在正八面体空隙中,有 2 个正八面体空隙没有填充阳离子,则有
50%的正八面体空隙没有填充阳离子;
(5)①根据原子 A 的坐标参数为(0,1,0),可知晶胞底面面心上的原子 B 的坐标为 1 1( ,0, )2 2
;
②由晶胞结构可知,处于面对角线上的铜镍原子间距离最短,设两者之间的距离为 a cm,则
晶胞面对角线长度为 2a cm,晶胞的棱长为 2 a cm,可得
3 3
A
59 64 3( 2 ) g·cm gacm d N
,解得 a= 3
A
2 251 cm2 dN
。
【选修 5:有机化学基础】
19. 呋喃酚是合成农药的重要中间体,其合成路线如下:
- 20 -
(1)A 物质的分子式为___________,B→C 的反应类型是___________;E 中含有的官能团名
称是___________,D 不能够发生的反应有___________(填序号)。
①氧化反应 ②取代反应 ③加成还原 ④消去反应
(2)已知 X 的分子式为 C4H7Cl,写出 A→B 的化学方程式:___________。
(3)Y 是 X 的同分异构体,分子中无环状结构、无支链且不含甲基,则 Y 的结构简式是
___________。
(4)下列有关化合物 B、C、D 、E 的说法正确的是___________。
①可用溴水鉴别 B 和 E
②可用氯化铁溶液鉴别 C 和 D
③C、D 互为同分异构体,B、E 互为同分异构体
④B、C、D、E 均能使酸性 KMnO4 溶液褪色
(5)B 的同分异构体很多,写出符合下列条件的同分异构体的结构简式:___________。
①含苯环、含有酯基 ②能发生银镜反应 ③在苯环上发生一氯取代时,产物只有一种
【答案】 (1). C6H6O2 (2). 取代反应 (3). (酚)羟基,醚键 (4). ④ (5).
+ +HCl (6). CH2=CHCH2CH2Cl (7).
②③④ (8).
【解析】
【详解】(1)A 的结构简式为 ,则分子式为 C6H6O2,B→C 发生的苯环上羟基的取
代反应,E 的结构简式为 ,含有(酚)羟基和醚键,D 的结构简式为 ,
- 21 -
有机物本身可以与氧气发生氧化反应,分子中的苯环可发生取代和加成反应,而苯环上的羟
基不能发生消去反应,故答案选④;
(2)对比 A、B 的结构,可知 A→B 属于取代反应,则 X 为 CH2=CH(CH3)CH2Cl, 反应还有
HCl 生成,反应方程式为 + +HCl;
(3)由(2)可知,X 为 CH2=CH(CH3)CH2Cl,Y 是 X 的同分异构体,分子中无支链且不含不含甲
基,则 Y 为 CH2=CHCH2CH2Cl;
(4)①B 和 E 均可以使溴水褪色,不能用溴水鉴别 B 和 E,①错误;
②C 不含有酚羟基,而 D 含有酚羟基,可以与氯化铁溶液发生显色反应,因此可以用氯化铁
溶液鉴别 C 和 D,②正确;
③C 和 D 的分子式相同,结构不同,互为同分异构体,B 和 E 的分子式也相同,互为同分异
构体,③正确;
④B、C、D 均含有碳碳双键,能够使酸性高锰酸钾溶液褪色,E 中酚羟基可与酸性高锰酸钾
溶液发生氧化反应使其褪色,④正确;
故答案选②③④;
(5)B 的同分异构体满足:含有苯环、酯基且能发生银镜反应,含有与甲酸形成的酯基,且环
上的一氯代物只有一种,结合 B 的结构可知,应还含有 4 个甲基,且为对称结构,符合条件
的同分异构体为: 、 。
【点睛】第 5 问是难点,含有酯基且能发生银镜反应说明是与甲酸反应生成的酯基,环上的
一氯代物只有一种或者很少,一般情况都是高度对称的结构,以此为突破口答题。
相关文档
- 河南省洛阳市第一高级中学2021届高2021-07-0913页
- 山东省济南市2021届高三上学期期中2021-07-0921页
- 天津市第一中学2021届高三上学期第2021-07-087页
- 北京市丰台区2021届高三上学期期末2021-07-0811页
- 2020-2021学年高三上学期月考化学2021-07-082页
- 金科大联考2021届高三上学期9月质2021-07-0825页
- 2020-2021学年高三上学期月考化学2021-07-0810页
- 陕西省西安市第一中学2021届高三上2021-07-0822页
- 河北省唐山市2021届高三上学期第一2021-07-0823页
- 2020-2021学年高三上学期月考理综-2021-07-0810页