- 768.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
琼海市 2013 年高考模拟测试
化 学 科 试 题
(时间:90 分钟 满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓
名、准考证号填写在答题卡上。
2.回答第 I 卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
5.本试卷满分 100 分,考试时间 90 分钟。
可能用到的相对原子质量:H 1 C l2 N 14 O 16 Na 23 Mg 24 S 32 C1 35.5
K 39 Fe 56 Ni 59 Cu 64 La l39
第Ⅰ卷
一、选择题:本题共 6 小题,每小题 2 分,共 12 分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1、2012 年 2 月 29 日,新发布的《环境空气质量标准》中增加了PM2.5 监测指标。PM2.5 是指
大气中直径小于或等于 2. 5 μm 的颗粒物,其主要来源之一是化石燃料的燃烧。下列措施能
减少 PM2.5 污染的是
A.鼓励使用液化石油气做燃料 B.鼓励使用太阳能、风能等能源
C.鼓励煤火力发电,少用水力发电 D.鼓励用私家车,少坐公交车出行
2、下列有关化学用语及其叙述,不正确...的是
A. 乙烯分子的结构简式:CH2=CH2 B. 12
6 C与 14
6 C互为同位素
3、下列关于有机物的叙述,正确的是
A. 乙烯能使溴水褪色,但不能使酸性 KMnO4 溶液褪色
B. 体积分数为 75%的酒精溶液不能使细菌蛋白质变性
C. 所有烷烃分子中都存在碳碳单键
D. 新制氢氧化铜悬浊液可用于检验葡萄糖的存在
4、在 pH=1 的某无色透明溶液中,能大量共存的离子组是
A.NH4
+、K+、SO4
2-、Br- B.K+、Na+、AlO2
-、Cl-
C.Fe3+、K+、SO4
2-、NO3
- D.K+、Na+、NO3
-、I-
5、下列实验操作中正确的是
A.蒸发时,只要蒸发皿中出现固体,立即停止加热
B.蒸馏时,温度计水银球应插入液体中,但不能碰到烧瓶内壁
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C. 氟离子结构示意图: D. 丙烷分子的球棍模型:
D.焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色
6、相同温度下,将等体积等 pH 的醋酸和盐酸溶液,分别加入 V1 mL、V2mL 的水稀释后,测得
溶液的 pH 仍然相同,则下列关系正确的是
A、V1 > V2 B、V1 < V2 C、V1 = V2 D、无法判断
二、不定项选择题(本题包括 6 小题,每小题 4 分,共 24 分。每小题有一个或两个选项符合
题意。若正确答案只包括一个选项,多选时,该题为 0 分;若正确答案包括两个选项,只
选一个且正确的得 2 分,选两个且都正确的得满分,但只要选错一个,该小题就为 0 分)
7、若 NA 表示阿伏加德罗常数,下列说法正确的是
A.0.1 L l mol·L-1 Na2CO3 溶液中,阴离子总数大于 0.1NA
B.标准状况下,22.4 L 氦气中含有的原子数为 2NA
C.100 g 98%的浓硫酸中,氧原子总数为 4NA
D.4.6 g 组成为 C2H6O 的有机物,C-H 键数目不一定为 0.5NA
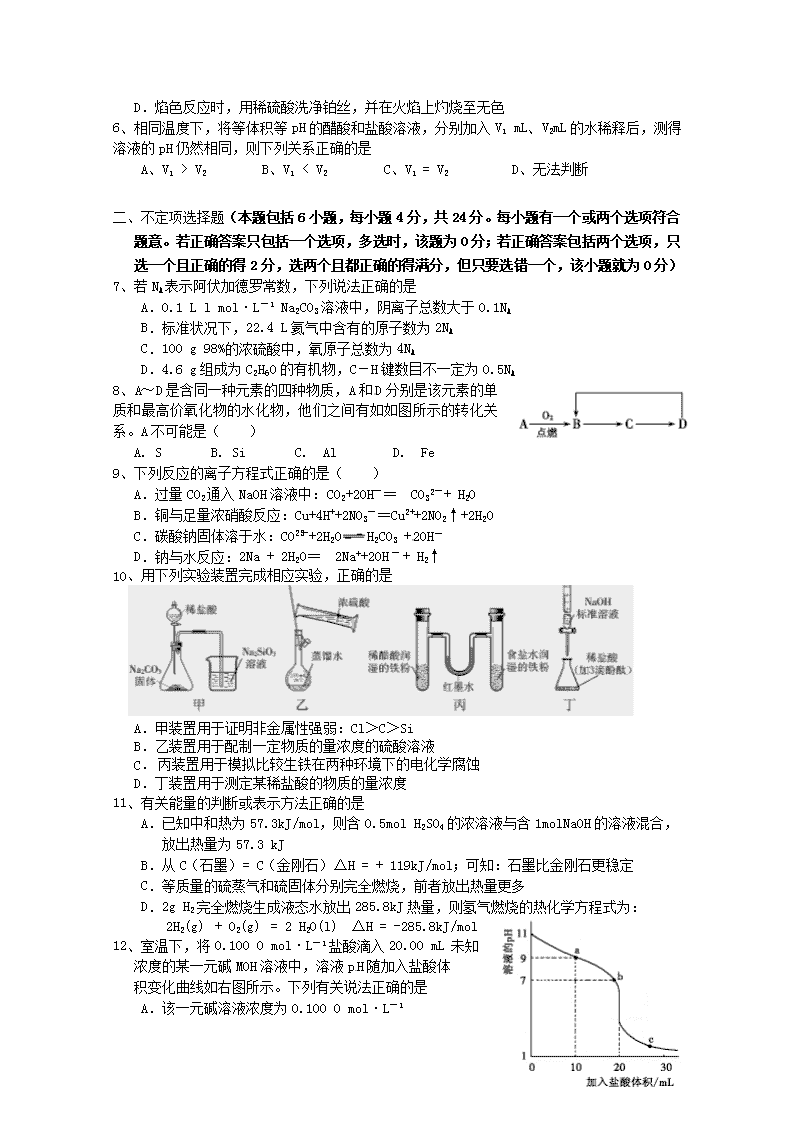
8、A~D 是含同一种元素的四种物质,A 和D 分别是该元素的单
质和最高价氧化物的水化物,他们之间有如如图所示的转化关
系。A 不可能是( )
A. S B. Si C. Al D. Fe
9、下列反应的离子方程式正确的是( )
A.过量 CO2 通入 NaOH 溶液中:CO2+2OH-= CO3
2-+ H2O
B.铜与足量浓硝酸反应:Cu+4H++2NO3
-=Cu2++2NO2↑+2H2O
C.碳酸钠固体溶于水:CO2-
3 +2H2O H2CO3 +2OH-
D.钠与水反应:2Na + 2H2O= 2Na++2OHˉ+ H2↑
10、用下列实验装置完成相应实验,正确的是
A.甲装置用于证明非金属性强弱:Cl>C>Si
B.乙装置用于配制一定物质的量浓度的硫酸溶液
C. 丙装置用于模拟比较生铁在两种环境下的电化学腐蚀
D.丁装置用于测定某稀盐酸的物质的量浓度
11、有关能量的判断或表示方法正确的是
A.已知中和热为 57.3kJ/mol,则含 0.5mol H2SO4 的浓溶液与含 1molNaOH 的溶液混合,
放出热量为 57.3 kJ
B.从 C(石墨)= C(金刚石)△H = + 119kJ/mol;可知:石墨比金刚石更稳定
C.等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
D.2g H2 完全燃烧生成液态水放出 285.8kJ 热量,则氢气燃烧的热化学方程式为:
2H2(g) + O2(g) = 2 H2O(l) △H = -285.8kJ/mol
12、室温下,将 0.100 0 mol·L-1 盐酸滴入 20.00 mL 未知
浓度的某一元碱 MOH 溶液中,溶液 pH 随加入盐酸体
积变化曲线如右图所示。下列有关说法正确..的是
A.该一元碱溶液浓度为 0.100 0 mol·L-1
B.a、b、c 点的水溶液导电性依次减弱
C.室温下,MOH 的电离常数 Kb=1×10-5
D.b 点:c(M+)+c(MOH)=c(Clˉ)
第Ⅱ卷
本卷包括必考题和选考题两部分。第 13 题~第 17 题为必考题,每个试题考生都必须做
答。第 18 题~第 20 题为选考题,考生根据要求做答。
13、(8 分)一定条件,物质 A~E 转化关系如右图,其中 A 为单质,常温下 E 为无色液体。
(1)若 A、C、D 均含氯元素,C 为氯碱工业的原料,D 溶液具有漂白性,则 A 与 B 反应的离
子方程式是 ;检验 C 中所含阴离子的操
作方法是 。
(2)若 A 为红色金属,B 为某酸的浓溶液,D 为可形成酸雨的无色气
体。A 与 B 反应的化学方程式是 。
(3)上述(1)、(2)中的 D 都能使品红溶液褪色,利用褪色后的溶液,
探究使品红溶液褪色的物质是什么,其实验方法是 。
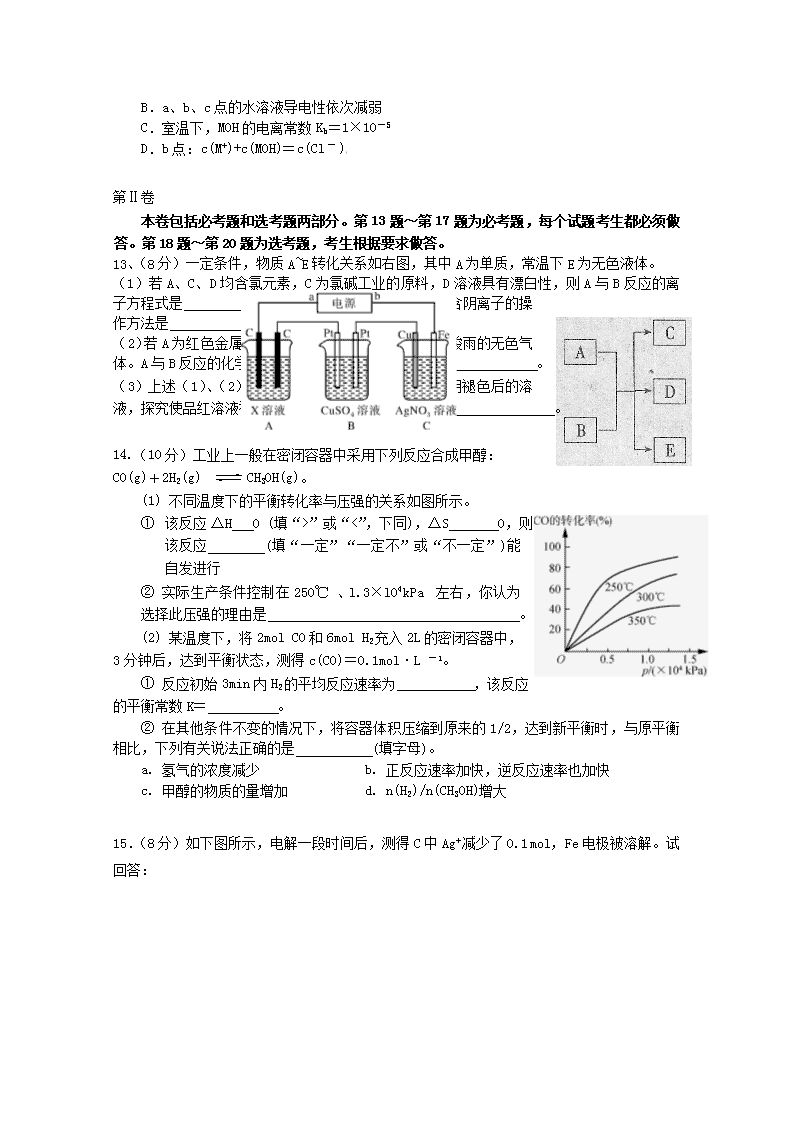
14.(10 分)工业上一般在密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
(1) 不同温度下的平衡转化率与压强的关系如图所示。
1 该反应ΔH 0 (填“>”或“<”,下同),ΔS 0,
则该反应 (填“一定”“一定不”或“不一定”)
能自发进行
② 实际生产条件控制在 250℃、l.3×l04kPa 左右,你认为选
择此压强的理由是 。
(2) 某温度下,将 2mol CO 和 6mol H2 充入 2L 的密闭容器中,3
分钟后,达到平衡状态,测得 c(CO)=0.1mol·L -1。
① 反应初始 3min 内 H2 的平均反应速率为 ,该反应
的平衡常数 K= 。
② 在其他条件不变的情况下,将容器体积压缩到原来的 1/2,达到新平衡时,与原平衡
相比,下列有关说法正确的是 (填字母)。
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. n(H2)/n(CH3OH)增大
15.(8 分)如下图所示,电解一段时间后,测得 C 中 Ag+ 减少了 0.1 mol,Fe 电极被溶解。
试回答:
(1)直流电源的 b 端是 (填“正”或“负”)极,C 中 Fe 电极的电极反应式
为 。
(2)当 C 中 Ag+ 减少 0.1 mol 时,B 中 Cu2+ 恰好完全析出为 Cu,假设电解前后溶液体积都
为 100 mL,则通电前 c(CuSO4)= ;若要将电解后的 B 恢复为原溶液,应向其中加入
的物质为 。
(3)若 A 中 X 溶液为 100 mL 1.1mol/L 的 HCl 溶液,假设电解产生的气体全部逸出,则产
生的所有气体在标准状况下的总体积为 ;电解后溶液的 pH 值为 。(假
设溶液体积不变)
16.(8 分)工业上可以用石油或淀粉作原料生产乙醇。
(1)用石油作原料生产乙醇的一系列反应如下图所示:
选择一种合适的试剂,完成反应③的化学方程式 。
(2)用淀粉为原料生产乙醇,需经水解、发酵等过程。写出发酵涉及的化学方程式(提示:
发酵过程中有 CO2 放出) 。
(3)有机物 A 是乙醇的一种同系物。6 g A 跟足量金属钠反应,产生的氢气在标准状况下的
体 积 为 1.12 L 。 则 A 的 分 子 式 为 , 可 能 的 结 构 简 式
为 ,
。
17、(10 分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭
火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2 NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
(1)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌
混合,生成的氨基甲酸铵晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
① 发 生 器 用 冰 水 冷 却 的 原 因
是 ,液体石蜡鼓泡瓶的作用
是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到
干燥产品,应采取的方法是 (填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空 40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用: ;浓硫酸
的作用: 、 。
(2)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品 0.782 0 g,用足量石灰
水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质
量为 1.000 g。则样品中氨基甲酸铵的物质的量分数为 。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
选考题(请考生在 18、19、20 三题中任选一题作答,如果多做,则按所做的第一题计分。作
答时用 2B 铅笔在答题卡上把所选题目的题号涂黑。)
第 18、19、20 三题的第一题为选择题,在给出的四个选项中,有两项是符合题目要求的,请
将符合题目要求的选项标号填在答题卡相应位置;第二题为非选择题,请在答题卡上相应位
置作答并写明小题号。
18.【选修 5——有机化学基础】(20分)
18-Ⅰ(6分)下列说法正确的是
A.苯酚显酸性,是因为羟基对苯环影响的结果
B.分子式为 C2H4 和 C3H6 的物质一定互为同系物
C.聚合物 是苯酚和甲醛在一定条件下反应得到的高分子化合物
D. 1mol 与足量的 NaOH 溶液加热充分反应,最多能消耗
4mol NaOH
18-Ⅱ(14 分)
根据下列有机化合物,回答问题。
(1)上述互为同分异构体的化合物为 (填代号);
(2)写出丙中官能团的名称 ;
(3)丁在一定条件下,可以发生水解反应,生成 X、Y 两种物质(相对分子质量:X<Y)。
由 X 经下列反应可制得 N、F 两种高分子化合物,它们都是常用的塑料。
①X 转化为 M 的反应类型是 。
②写出 B 转化为 C 的化学方程式 。
③C 与新制氢氧化铜反应的化学方程式为: 。
④在一定条件下,两分子 E 能脱去两分子水形成一种六元环状化合物,该化合物的结构
简式为 。
⑤写出 3 种含有一个羟基、一个酯基的 E 的同分异构体的结构简式:
、 、 。
19.【选修 3——物质结构与性质】(20分)
19-Ⅰ(6 分)下列说法中正确的是 。
A.丙烯分子中有 8 个σ键,1 个π键
B.在 SiO2 晶体中,1 个 Si 原子和 2 个 O 原子形成 2 个共价键
C.NF3 的沸点比 NH3 的沸点低得多,是因为 NH3 分子间有氢键,NF3 只有范德华力
D.NCl3 和 BC13 分子中,中心原子都采用 sp3 杂化
19-II(14 分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被
科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti 元素在元素周期表中的位置是第________周期第________族;其基态原子的电子
排布式为________。
(2)在 Ti 的化合物中,可以呈现+2、+3、+4 三种化合
价,其中以+4 价的 Ti 最为稳定。偏钛酸钡的热稳定
性好,介电常数高,在小型变压器、话筒和扩音器中
都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图
所示,它的化学式是 ,其中 Ti4+的氧配位数为 ,Ba2+的氧配
位数为 ,
(3)常温下的 TiCl4 是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点 136.2℃,所以
TiCl4 应是 化合物,其固体是 晶体。TiCl4 在潮湿空气中易挥发,
水解而冒白烟,这是因为水解后有 生成。
(4)已知 Ti3+可形成配位数为 6 的配合物,其空间构型为正八面体,如下图 1 所示,我
们通常可以用下图 2 所示的方法来表示其空间构型(其中 A 表示配体,M 表示中心原
子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构
体,请在下图方框中将其画出。
20.【选修 2——化学与技术】(20分)
20-Ⅰ(6 分)化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排
放
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.为了有效的发展清洁能源,采用电解水的方法大量制备 H2
D.世博停车场安装催化光解设施,可将汽车尾气中 CO 和 NOx 反应生成无毒气体
20-II(14 分)
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海
水加工的示意图,根据下图回答问题。
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中①②的化学式:① ,
② ,吸收塔中发生的化学反应方程式为 。
图 1 图 2
淡 水
食 盐
溴
镁
重 水海 水
浓缩海水海
水
淡
化
工
厂
浓缩
海水
含 Br2
溶液
含 ①
吸收塔
含浓 Br—
溶液
浓 Br2
溶液
含 Br2 空气
空气和水蒸气C12 ②
(3)制备金属镁是通过电解熔融的 MgC12,而不用 MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备 NaOH、H2
和 C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉
淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食
盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
(5)多晶硅主要采用 SiHCl3 还原工艺生产,其副产物 SiCl4 可转化为 SiHCl3 而循环使用。
一定条件下,在 20L 恒容密闭容器中的反应:3 SiCl4(g)+2 H2(g)+Si(g)
4 SiHCl3(g)。达平衡后,H2 与 SiHCl3 物质的量浓度分别为 0.140mol/L 和 0.020mol/L,
若 H2 全部来源于氯碱工业,理论上需消耗纯 NaCl 的质量为 kg。
琼海市 2013 高考模拟测试
化学科参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案 B C D A C A AD D BD C BC AC
13、(8 分)
(1)Cl2+2OH- Cl-+ClO-+H2O(2 分);取少量待测液于试管中,滴入少量稀硝酸酸化,
再滴入 AgNO3 溶液,若产生白色沉淀,则证明有 Cl-(2 分)
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;(2 分)
(3)取少量褪色后的溶液加热,若溶液恢复红色,则是 SO2 使品红褪色,若溶液不变红,
则是 NaClO 使品红褪色(合理答案均得分)(2 分)
14.(10 分)
(1) ① < < 不一定 (每空 1 分,共 3 分)
② 该压强下,CO 转化率已较高,再增大压强,CO 转化率提高不大,且生产成本增加(1
分)
(2) ① 0.60mol·L -1min-1 (2 分) 6.25 (2 分)
② bc(2 分)
15.(8 分)
(1) 正 (1 分) Fe-2e- == Fe2+(1 分)
(2)0.5 mol/L (1 分) CuO 或 CuCO3 (1 分)
(3)2.24L (2 分) 1(2 分)
16.(8 分)
(1)CH2=CH2 + H2O 一定条件 CH3CH2OH(2 分)
(2)
C6H12O6(葡萄糖) 一定条件 2 CH3CH2OH+2CO2↑(2 分)
(3) C3H8O CH3CH2CH2OH CH3—CH—OH (2+1+1 分)
︱
CH3
17、(10 分)
(1)① 提高反应物转化率,防止因反应放热造成产物分解(2 分)
通过观察气泡,调节 NH3 与 CO2 通入比例(1 分)
② 过滤 c(各 1 分,共 2 分)
③ 防止倒吸(1 分)
吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解 (2 分)
(2)80.00%(2 分)
18.【选修 5——有机化学基础】
18-Ⅰ(6 分)CD
18-Ⅱ(14 分)
(1)甲、乙、丙 (2 分) (2)醛基、羟基(2 分)
(3)(第①和第⑤题每空 1 分,其余每空 2 分)
①消去反应
② (2 分)
③
19.【选修 3——物质结构与性质】19.(20 分)
19-Ⅰ(6 分)(6 分)AC(答对 1 个得 3 分,见错得 0 分。)
19-II(14 分)
(1)四(1 分) IVB(1 分) [Ar]3d24s2(1 分)
(2)BaTiO3 (2 分) 6(1 分) 12(1 分)
(3)共价(1 分) 分子(1 分) HC1(1 分)
(4)2(2 分)
(2 分)
20.【选修 2——化学与技术】20.(20 分)
20-Ⅰ(6 分)(6 分)BD
20-II(14 分)
(1)蒸馏法、电渗析法 (2 分)
(2)①SO2 (1 分) ②C12 (1 分) SO2 + C12 + 2H2O = H2SO4 + 2HC1(2 分)
(3)MgO 熔点很高,会消耗大量电能 (2 分)
(4)用试剂处理后的盐水中还含有少量 Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交
换膜。(2 分)
防止 H2 与 C12 混合发生爆炸,同时防止 C1—进入阴极室,这样可以获得纯净的 NaOH。(2
分)
(5)0.35 (2 分)
相关文档
- 备战2021 高考化学 考点62 烃的含2021-07-0938页
- 高考化学二轮复习热点例析专题二第2021-07-0910页
- 高考化学一轮复习第九章单元跟踪强2021-07-0911页
- 高考化学第一轮复习课件第2讲 元2021-07-097页
- 备战2021 高考化学 考点61 烃和卤2021-07-0918页
- 高考化学5年高考真题精选与最新模2021-07-0960页
- 备战2021 高考化学 考点54 基本营2021-07-0917页
- 高考化学二轮复习热点例析专题二第2021-07-0915页
- 备战2021 高考化学 考点16 铁及其2021-07-0917页
- 备战2021 高考化学 考点55 微型实2021-07-0922页