- 852.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
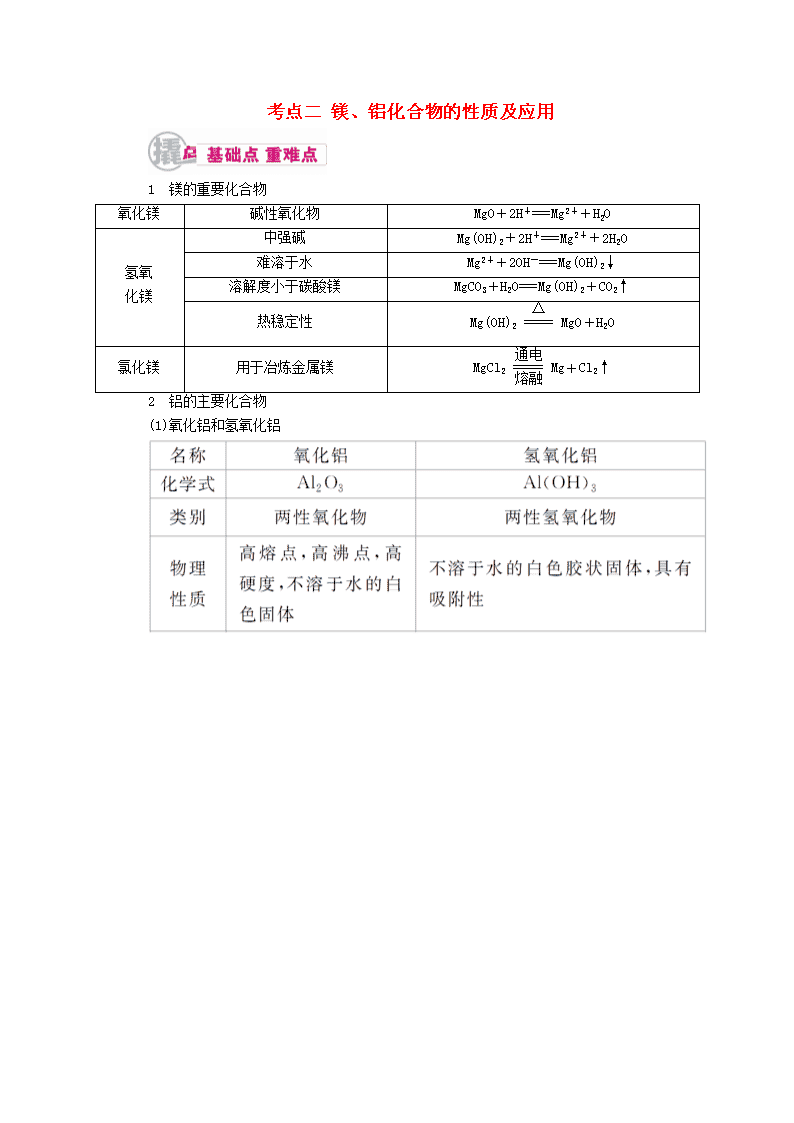
考点二 镁、铝化合物的性质及应用
1 镁的重要化合物
氧化镁 碱性氧化物 MgO+2H+===Mg2++H2O
氢氧
化镁
中强碱 Mg(OH)2+2H+===Mg2++2H2O
难溶于水 Mg2++2OH-===Mg(OH)2↓
溶解度小于碳酸镁 MgCO3+H2O===Mg(OH)2+CO2↑
热稳定性
Mg(OH)2=====
△
MgO+H2O
氯化镁 用于冶炼金属镁 MgCl2=====
通电
熔融
Mg+Cl2↑
2 铝的主要化合物
(1)氧化铝和氢氧化铝
(2)复盐——硫酸铝钾
①复盐定义:由两种不同的金属离子(或 NH+
4 )与一种酸根离子组成的盐叫复盐。
②明矾
明矾的化学式为 KAl(SO4)2·12H2O,可溶于水,电离方程式为 KAl(SO4)2===K++Al3++
2SO2-
4 。水溶液的 pH<7(填“>”“<”或“=”),原因是 Al3++3H2O Al(OH)3+3H+。
明矾可用于净水,其原因是 Al3+水解产生 Al(OH)3 胶体,Al(OH)3 胶体可以和悬浮于水中
的泥沙形成絮状不溶物而沉降下来,使水澄清。
学霸巧学卡 对镁、铝化合物的深层解析
(1)由于 Mg(OH)2 的溶解度比 MgCO3 的小,故水垢的主要成分中是 Mg(OH)2,而非 MgCO3。
(2)Al2O3、Al(OH)3 只与强酸、强碱溶液反应,与氨水和碳酸溶液不反应。
(3)Al3+只能存在于酸性溶液中,AlO -
2 只能存在于碱性溶液中。若将分别含 Al3+和 AlO -
2
的盐溶液混合,发生反应:Al3++3AlO-
2 +6H2O===4Al(OH)3↓。
(4)Al2O3、Al(OH)3 是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用
到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(5)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯气消毒原理不同。
1.思维辨析
(1)在加热情况下利用氢气还原氧化铝的方法得到金属铝。( )
(2)将 Al(OH)3 沉淀转入蒸发皿中,加足量稀硫酸,加热蒸干得无水 Al2(SO4)3 固体。( )
(3)将 NaOH 溶液缓慢滴入 Al2(SO4)3 溶液中至过量,最终观察到有沉淀生成。( )
(4)日用铝制品表面覆盖着氧化膜对内部金属起保护作用。( )
(5)Al2O3 的熔点很高,可用作耐高温材料。( )
(6)明矾水解形成的 Al(OH)3 胶体能吸附水中的悬浮物,可用于对水的杀菌、消毒。( )
答案 (1)× (2)√ (3)× (4)√ (5)√ (6)×
2.将等体积的 AlCl3 溶液和 NaOH 溶液混合后,沉淀物中含铝元素的物质的量与溶液中
含铝元素的物质的量相等,则原 AlCl3 溶液与 NaOH 溶液的物质的量浓度之比是 ( )
A.1∶3 B.2∶5
C.1∶4 D.2∶7
答案 D
解析 设 AlCl3 和 NaOH 的物质的量分别为 a、b。当 NaOH 少量时,铝元素以 Al3+和 Al(OH)3
形式存在,a
2
×3=b,a∶b=2∶3;当 NaOH 过量时,铝元素以 Al(OH)3 和 AlO -
2 形式存在,a
2
×3
+a
2
×4=b,a∶b=2∶7。
[考法综述] 铝的化合物是高考命题的热点,主要是“铝三角”的转化关系及应
用,涉及内容较多,如书写离子方程式,离子共存的判断,实验操作中的鉴别、分离、提纯,
结合图象的分析或计算等,综合性较强,属较难题。
命题法 1 常见的两性物质
典例 1 下列物质既能跟盐酸反应,又能跟 NaOH 溶液反应的是( )
①SiO2 ②Al ③Al2O3 ④Al(OH)3 ⑤Na2CO3 溶液 ⑥Ca(HCO3)2 溶液 ⑦NH4HCO3 溶液
⑧KHSO4 溶液
A.④⑥⑦⑧ B.②③④⑥⑦
C.①②③④⑦ D.②③④⑤⑧
[解析] SiO2 只能与 NaOH 溶液反应,与盐酸不反应;Al、Al2O3、Al(OH)3、Ca(HCO3)2、
NH4HCO3 既能跟盐酸反应,又能跟 NaOH 溶液反应;Na2CO3 只能与盐酸反应,与 NaOH 溶液不反
应;KHSO4 只能与 NaOH 溶液反应,与盐酸不反应。
[答案] B
【解题法】 常见的两性物质归纳总结
(1)中学学习阶段接触到的既能与酸反应又能与碱反应的物质有:①金属单质:Al 等;
②两性氧化物:Al2O3 等;③两性氢氧化物:Al(OH)3 等;④弱酸的铵盐:(NH4)2CO3、CH3COONH4、
(NH4)2S 等;⑤弱酸的酸式盐:NaHCO3、KHS、NaHSO3 等;⑥氨基酸等。
(2)两性物质:是指既能与酸反应又能与碱反应生成盐和水的化合物,上述物质中只有
Al2O3、Al(OH)3、氨基酸是两性物质。
命题法 2 “铝三角”转化关系
典例 2 下列各组物质,不能按 (“―→”表示反应一步完成)
关系转化的是( )
选项 a b c
A Al2O3 NaAlO2 Al(OH)3
B AlCl3 Al(OH)3 NaAlO2
C Al Al(OH)3 Al2O3
D MgCl2 Mg(OH)2 MgO
[ 解 析 ] 各 选 项 中 物 质 间 的 转 化 为 : A 项 ,
Al2O3 ――→
NaOH
NaAlO2 ――→
CO2
Al(OH)3 ――→
△
Al2O3 ; B 项 ,
AlCl3 ――→
NH3·H2O
Al(OH)3 ――→
NaOH
NaAlO2 ――→
HCl
AlCl3 ; D 项 ,
MgCl2――→
NaOH
Mg(OH)2――→
△
MgO――→
HCl
MgCl2;C 项中,Al 不能一步转化成 Al(OH)3。
[答案] C
【解题法】 “铝三角”间的转化关系
相互转化的离子方程式如下:
(1)Al3++3OH-===Al(OH)3↓
或 Al3++3NH3·H2O===Al(OH)3↓+3NH+
4
(2)Al(OH)3+OH-===AlO-
2 +2H2O
(3)Al3++4OH-===AlO-
2 +2H2O
(4)AlO-
2 +H++H2O===Al(OH)3↓
或 AlO-
2 +CO2+2H2O===Al(OH)3↓+HCO-
3
(5)Al(OH)3+3H+===Al3++3H2O
(6)AlO-
2 +4H+===Al3++2H2O
相互关系:①+②=③,④+⑤=⑥,注意,Al(OH)3 只溶于强酸强碱。
命题法 3 含 Al3+的混合溶液中滴加 NaOH 的图象题
典例 3 某溶液中可能含有 H+、Na+、NH+
4 、Mg2+、Fe3+、Al3+、SO2-
4 、CO 2-
3 等。当向该
溶液中加入一定物质的量浓度的 NaOH 溶液时,发现生成沉淀的物质的量随 NaOH 溶液的体积
变化的图象如图所示。下列说法正确的是( )
A.原溶液中含有的阳离子是 H+、NH+
4 、Mg2+、Al3+
B.原溶液中一定含有 SO 2-
4 和 Na+
C.原溶液中含有的 Fe3+和 Al3+的物质的量之比为 1∶1
D.反应最后形成的溶液中含有的溶质为 Na2SO4
[解析] 从题中图象可知,滴入氢氧化钠溶液的过程中发生了四种反应:开始一个单位
是中和反应,接下来六个单位是沉淀反应,再接下来的两个单位是铵根离子与氢氧根离子的
反应,最后一个单位为氢氧化铝的溶解,由此确定生成氢氧化铝需要的氢氧化钠为三个单位,
另外三个单位的氢氧化钠生成的是氢氧化铁沉淀;有铝离子则没有碳酸根离子。因此可以确
定有 H+、NH+
4 、Fe3+、Al3+、SO2-
4 ,不能确定是否有 Na+,可以确定没有 Mg2+、CO2-
3 。
[答案] C
【解题法】 含 Al3+的混合溶液与 OH-反应的先后顺序
当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有 H+、NH+
4 、Mg2+、Al3+
的混合溶液中逐滴加入 NaOH 溶液,NaOH 先与 H+反应,再与 Mg2+、Al3+反应生成沉淀,再与
NH +
4 反应,最后才溶解 Al(OH)3 沉
淀。即“先结合,后溶解”。若不清楚结合的先后顺序,则可以采用“假设法”,如假
设 NH +
4 先与 OH-结合,则会发生 NH+
4 +OH-===NH3·H2O,但溶液中的 Al3+、Mg2+会与 NH3·H2O
反应又生成 NH+
4 ,所以 NH +
4 不能优先于 Al3+和 Mg2+与 OH-结合。若要正确排出结合的先后顺
序,需熟练掌握离子间的反应原理。
命题法 4 “铝三角”的主要应用
典例 4 Al(OH)3 的制备
若甲、乙、丙三位同学用规定的药品制备 Al(OH)3。规定必用的药品如下:350 g 70% H2SO4
溶液,NaOH 固体 240 g,足量铝屑、水(不能用其他药品)。
甲、乙、丙用各自设计的方案制得 Al(OH)3 的质量分别是 W1、W2、W3。三种实验方案如
下:
甲:铝→加 NaOH 溶液→加 H2SO4 溶液→W1 gAl(OH)3
乙:铝→加 H2SO4 溶液→加 NaOH 溶液→W2 gAl(OH)3
丙:
铝→加 H2SO4 溶液
铝→加 NaOH 溶液
→W3 gAl(OH)3
试回答:
(1)从充分利用原料、降低成本和提高产率等因素分析,实验方案最合理的是________。
(2) 三 位 学 生 制 得 的 Al(OH)3 , W1 、 W2 、 W3 其 质 量 由 大 到 小 的 顺 序 是
____________________________________。
[解析] n(NaOH)= 240 g
40 g·mol-1=6 mol,n(H2SO4)=350 g×70%
98 g·mol-1=2.5 mol,
甲方案:2Al+2NaOH+2H2O===2NaAlO2+3H2↑
6 mol ⇒ 6 mol
AlO-
2 + H+ +H2O===Al(OH)3↓
过量 2.5×2 mol ⇒ 5 mol
因此,甲方案最多制得 5 mol Al(OH)3。
乙方案:2Al+3H2SO4===Al2(SO4)3+3H2↑
2.5 mol ⇒1
3
×2.5 mol
Al2(SO4)3+ 6NaOH===2Al(OH)3↓+Na2SO4
1
3
×2.5 mol 过量 ⇒2
3
×2.5 mol
因此,乙方案最多制得5
3
mol Al(OH)3。
丙方案:2Al+6H+===2Al3++3H2↑
5 mol⇒5
3
mol
2Al+2OH-+2H2O===2AlO-
2 +3H2↑
6 mol ⇒ 6 mol
Al3++3AlO-
2 +6H2O===4Al(OH)3↓
5
3
mol 过量 ⇒ 20
3
mol
因此,丙方案最多制得 20
3
mol Al(OH)3。
故 W3>W1>W2。
[答案] (1)丙 (2)W3>W1>W2
典例 5 与铝元素有关的物质的分离、提纯
下列除去杂质的方法不正确的是( )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去 Fe3+溶液中的少量 Al3+
C.Al(OH)3 中混有少量 Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入
过量 CO2 后过滤
D.MgO 中混有少量 Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到 MgO
[解析] Al(OH)3 不溶于氨水,故向含少量 Al3+的 Fe3+溶液中加入过量氨水时,Fe3+、
Al3+均转化为氢氧化物沉淀,达不到除杂的目的。
[答案] B
典例 6 利用“铝三角”转化关系进行物质鉴别
下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3
②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4
④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③
C.①③④ D.①②④
[解析] 不用其他试剂鉴别,即用物质间相互滴加现象不同来鉴别。①中,将 KOH 逐滴
滴入 AlCl3 溶液中时,先后发生反应 Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO-
2 +2H2O,
现象是:白色沉淀生成→溶解至消失;而将 AlCl3 逐滴滴入 KOH 溶液中时,先后发生 Al3++
4OH-===AlO-
2 +2H2O;Al3++3AlO-
2 +6H2O===4Al(OH)3↓,现象是:开始无明显现象→白色沉
淀逐渐增多。两种滴加方式不同,现象也不同,从而可以鉴别。②中 NaHCO3 和 H2SO4 分别滴
加到 Ba(OH)2 中都有白色沉淀生成,但 BaCO3 沉淀溶于 H2SO4 中,且有气泡产生的是 NaHCO3
和 H2SO4 溶液混合,可鉴别出各种物质。③中 HCl 和 NaHSO4 都显酸性,无法鉴别。④中 CaCO3
和 BaCO3 都是白色沉淀,无法鉴别出 Ca(OH)2 和 BaCl2,所以答案为 A。
[答案] A
典例 7 利用 Al3+或 AlO -
2 的存在环境进行离子共存的判断
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色溶液中:ClO-、MnO-
4 、Al3+、K+
B.1.0 mol·L-1 的 NaAlO2 溶液中:Cl-、HCO-
3 、K+、Ca2+
C.在强碱性环境中:AlO-
2 、SiO2-
3 、Na+、K+
D.能使甲基橙显红色的溶液中:NH+
4 、AlO-
2 、Na+
[解析] A 项 MnO -
4 有颜色,ClO-与 Al3+可发生双水解反应;B 项中 HCO-
3 +AlO-
2 +
H2O===Al(OH)3↓+CO2-
3 ;D 项中,酸性条件下 AlO -
2 不能大量存在。
[答案] C
【解题法】 “铝三角”关系的应用小结
(1)Al(OH)3 的制备
方法一:可溶性铝盐溶液与过量氨水反应
反应原理:Al3++3NH3·H2O===Al(OH)3↓+3NH+
4
方法二:向可溶性偏铝酸盐溶液中通入过量 CO2
反应原理:AlO-
2 +2H2O+CO2===Al(OH)3↓+HCO-
3
方法三:相互促进水解法
Al3++3AlO-
2 +6H2O===4Al(OH)3↓
(2)含铝元素的混合物的分离提纯
利用 Al、Al2O3、Al(OH)3 可溶于强碱的特性,可除去许多物质中的含铝杂质,如:
①Mg(Al):加足量 NaOH 溶液;
②Fe2O3(Al2O3):加足量 NaOH 溶液;
③Mg(OH)2[Al(OH)3]:加足量 NaOH 溶液;
④Mg2+(Al3+):加过量 NaOH 溶液,过滤,再加酸充分溶解。
(3)鉴别(利用滴加试剂顺序不同,现象不同)
①向 AlCl3 溶液中滴加 NaOH 溶液,先产生白色沉淀,后沉淀溶解。
②向 NaOH 溶液中滴加 AlCl3 溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
③向 NaAlO2 溶液中滴加 HCl 溶液,开始产生白色沉淀,后沉淀逐渐溶解。
④向 HCl 溶液中滴加 NaAlO2 溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
(4)判断离子共存问题
Al3+与 OH-、AlO-
2 、CO2-
3 、S2-等弱酸根阴离子或 AlO -
2 与 H+、HCO -
3 以及弱碱阳离子 Al3+、
Fe3+等因生成沉淀或发生水解相互促进的反应而不能大量共存。
1.某化合物由两种单质直接反应生成,将其加入 Ba(HCO3)2 溶液中同时有气体和沉淀产
生。下列化合物中符合上述条件的是( )
A.AlCl3 B.Na2O
C.FeCl2 D.SiO2
答案 A
解析 FeCl2 不能由 Fe 和 Cl2 直接反应生成,C 项错误;SiO2 不溶于水,也不能与 Ba(HCO3)2
溶液反应,D 项错误;Na2O 可由 Na 和 O2 直接反应生成,Na2O+H2O===2NaOH,2NaOH+
Ba(HCO3)2===BaCO3↓+Na2CO3+2H2O,反应中无气体生成,B 项错误;AlCl3 可由 Al 与 Cl2 直
接反应生成,将 AlCl3 加入 Ba(HCO3)2 溶液中,Al3++3HCO-
3 ===Al(OH)3↓+3CO2↑,发生强烈
双水解反应,生成 Al(OH)3 沉淀和 CO2 气体,A 项正确。
2.用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
( )
选项 ①中物质 ②中物质 预测②中的现象
A 稀盐酸 碳酸钠与氢氧化钠的混合溶液 立即产生气泡
B 浓硝酸 用砂纸打磨过的铝条 产生红棕色气体
C 氯化铝溶液 浓氢氧化钠溶液 产生大量白色沉淀
D 草酸溶液 高锰酸钾酸性溶液 溶液逐渐褪色
答案 D
解析 稀盐酸滴入 Na2CO3 和 NaOH 的混合溶液中,先发生酸碱中和反应,开始没有气泡
产生,A 项错误;浓硝酸与 Al 发生钝化,无红棕色的 NO2 生成,B 项错误;将 AlCl3 溶液滴
入 NaOH 溶液中,开始无大量白色沉淀,C 项错误;草酸与酸性 KMnO4 溶液发生氧化还原反应,
KMnO4 溶液的紫红色褪去,D 项正确。
3.化学与生活密切相关。下列说法不正确的是( )
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D.氢氧化铝可作胃酸的中和剂
答案 C
解析 乙烯是一种植物生长调节剂,可以催熟果实,A 正确;硅胶无毒,可用作食品的
干燥剂,B 正确;福尔马林是 35%~40%的甲醛水溶液,有毒,C 错误;氢氧化铝可以中和盐
酸,可作胃酸的中和剂,D 正确。
4.常温下,下列各组物质中,Y 既能与 X 反应又能与 Z 反应的是( )
X Y Z
① NaOH 溶液 Al(OH)3 稀硫酸
② KOH 溶液 SiO2 浓盐酸
③ O2 N2 H2
④ FeCl3 溶液 Cu 浓硝酸
A.①③ B.①④
C.②④ D.②③
答案 B
解析 本题考查常见物质的性质,意在考查考生利用所学知识分析问题的能力。Al(OH)3
显两性,既能与酸反应生成盐和水,又能与碱反应生成盐和水,①正确;SiO2 与盐酸不反应,
②错误;N2 与 O2 在放电条件下反应生成 NO,N2 在高温、高压及催化剂存在条件下与 H2 反应
生成 NH3,但在常温时 N2 与 O2、H2 均不反应,③错误;根据方程式:Cu+2FeCl3===CuCl2+2FeCl2、
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 可知,④正确。
5.室温下,在 0.2 mol·L-1 Al2(SO4)3 溶液中,逐滴加入 1.0 mol·L-1 NaOH 溶液,实
验测得溶液 pH 随 NaOH 溶液体积变化曲线如下图,下列有关说法正确的是( )
A.a 点时,溶液呈酸性的原因是 Al3+水解,离子方程式为 Al3++3OH- Al(OH)3
B.a~b 段,溶液 pH 增大,Al3+浓度不变
C.b~c 段,加入的 OH-主要用于生成 Al(OH)3 沉淀
D.d 点时,Al(OH)3 沉淀开始溶解
答案 C
解析 本题考查铝的化合物的转化、水解平衡的移动以及图象分析。Al3+水解方程式为
Al3++3H2O Al(OH)3+3H+,A 项错误;a~b 段,加入 NaOH 主要是与水解生成的 H+反应,
pH 增大,促进水解,Al3+浓度减小,B 项错误;b~c 段 pH 增大缓慢,主要是生成氢氧化铝
沉淀,C 项正确;c 点后 pH 增大加快,主要是发生反应 Al(OH)3 +OH-===AlO-
2 +2H2O,d 点
表示氢氧化铝完全溶解,D 项错误。
6.a g Mg、Al 合金完全溶解在 c1 mol·L-1、V1 L HCl 溶液中,产生 b g H2。再向反应
后的溶液中加入 c2 mol·L-1、V2 L NaOH 溶液,恰好使沉淀达到最大值,且沉淀质量为 d g。
下列关系错误的是( )
A.与金属反应后剩余盐酸为(c1V1-b) mol
B.c1=c2V2
V1
C.铝失去电子的物质的量为 b mol
D.d=a+17b
答案 C
解析 反应后的溶液中溶质为 NaCl,根据 Cl 原子守恒可得 c1V1=c2V2,即 c1=c2V2
V1
,B
项正确;根据题意可知消耗的 n(HCl)=b
2
×2 mol=b mol,故剩余的 HCl 的物质的量为(c1V1
-b) mol,A 项正确;题中的沉淀为 Al(OH)3、Mg(OH)2,故有 n(OH-)=n(H+)=2n(H2),沉淀
质量为(a+17b) g,D 项正确;C 项设 n(Mg)=x mol,n(Al)=y mol,
则
24x+27y=a
2x+3y=b
2
×2, 求得:y=12b-a
9
,
所以铝失电子的物质的量为
4b-a
3 mol,C 项错误。
7.无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为
____________________。
(2)工业上用铝土矿(主要成分为 Al2O3,含有 Fe2O3、SiO2 等杂质)制取无水氯化铝的一种
工艺流程示意如下:
已知:
物质 SiCl4 AlCl3 FeCl3 FeCl2
沸点/℃ 57.6 180(升华) 300(升华) 1023
① 步 骤 Ⅰ 中 焙 烧 使 固 体 水 分 挥 发 、 气 孔 数 目 增 多 , 其 作 用 是
_______________________________________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________。
③已知:
Al2O3(s)+3C(s)===2Al(s)+3CO(g)ΔH1=+1344.1 kJ·mol-1
2AlCl3(g)===2Al(s)+3Cl2(g)ΔH2=+1169.2 kJ·mol-1
由 Al2O3、C 和 Cl2 反应生成 AlCl3 的热化学方程式为______________________。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的 NaOH 冷溶液吸收,生成的盐主要有 3
种,其化学式分别为____________。
⑤ 结 合 流 程 及 相 关 数 据 分 析 , 步 骤 Ⅴ 中 加 入 铝 粉 的 目 的 是
_________________________________________________________。
答案 (1)Al3++3H2O Al(OH)3+3H+
(2)①防止后续步骤生成的 AlCl3 水解(或增大反应物的接触面积,加快反应速率)
②铁(或 Fe)
③Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g)
ΔH=+174.9 kJ·mol-1
④NaCl、NaClO、Na2CO3
⑤除 FeCl3 杂质,提高 AlCl3 纯度
解析 (1)AlCl3 溶于水,Al3+水解生成 Al(OH)3 胶体。
(2)①步骤Ⅰ中焙烧时,固体水分挥发,可以防止后续步骤生成的 AlCl3 水解;气孔数
目增多,可以增大反应物的接触面积,加快反应速率。②铝土矿粉和焦炭焙烧时,焦炭能还
原 Fe2O3 得到单质铁。③根据盖斯定律,由题中第一个热化学方程式减去第二个热化学方程
式可得 Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+1344.1 kJ·mol - 1 -
1169.2 kJ·mol-1=+174.9 kJ·mol-1。④步骤Ⅲ的尾气中含有 Cl2、CO2、O2 等,用足量 NaOH
冷溶液吸收,生成的盐主要有 NaCl、NaClO、Na2CO3。⑤根据图示流程知 AlCl3 粗品中含有杂
质 FeCl3、SiCl4,根据提供数据知 SiCl4 沸点较低,步骤Ⅴ中加入铝粉,将 FeCl3 转化为 AlCl3,
以提高 AlCl3 的纯度。
工业上用铝土矿(主要成分为 Al2O3,含 Fe2O3 等杂质)为原料冶炼铝的工艺流程如下:
下列判断正确的是( )
A.试剂 X 为稀硫酸
B.反应Ⅱ的离子方程式为 CO2+AlO-
2 +2H2O===Al(OH)3↓+HCO-
3
C.反应Ⅰ、Ⅱ、Ⅲ、Ⅳ的反应类型完全相同
D.反应Ⅰ所得的沉淀无任何价值
[错解] A 或 C
[错因分析] 不清楚 Al2O3、Fe2O3 的性质差异,错误判断试剂 X 为稀硫酸。不仔细阅读
流程信息,思维单一,不能根据反应Ⅱ的产物写出其离子方程式,对基础知识不熟悉,认为
B 项应生成 CO2-
3 。不熟悉原理和常规实验操作而错选 C。
[解析] 选项 A,试剂 X 应是 NaOH 溶液;选项 B,溶液乙中含有 AlO-
2 ,AlO -
2 与过量 CO2、
H2O 反应生成 Al(OH)3 沉淀,正确;选项 C,反应Ⅰ、Ⅱ是复分解反应,反应Ⅲ是分解反应,
反应Ⅳ是电解 Al2O3 生成 Al 的反应,属于分解反应,且该反应有电子转移,是氧化还原反应;
选项 D,反应Ⅰ所得沉淀的主要成分为 Fe2O3,经提纯后可用于作颜料或冶铁等。
[答案] B
[心得体会]
相关文档
- 高考化学第一轮复习课件第4讲 氮2021-07-095页
- 备战2021 高考化学 考点62 烃的含2021-07-0938页
- 高考化学4月模拟测试试题2021-07-0910页
- 高考化学二轮复习热点例析专题二第2021-07-0910页
- 高考化学一轮复习第九章单元跟踪强2021-07-0911页
- 高考化学第一轮复习课件第2讲 元2021-07-097页
- 备战2021 高考化学 考点61 烃和卤2021-07-0918页
- 高考化学5年高考真题精选与最新模2021-07-0960页
- 备战2021 高考化学 考点54 基本营2021-07-0917页
- 备战2021 高考化学 考点55 微型实2021-07-0922页