- 217.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课后作业(二十三)
[基础巩固]
一、离子键与离子化合物
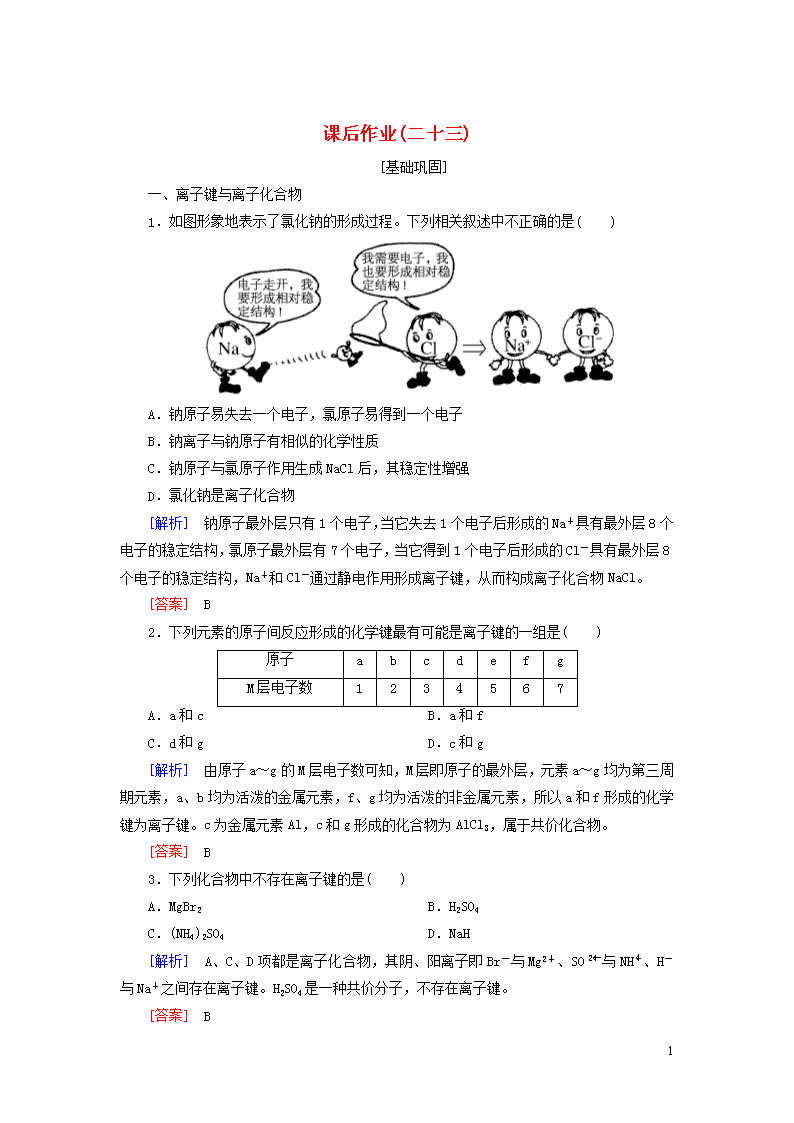
1.如图形象地表示了氯化钠的形成过程。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其稳定性增强
D.氯化钠是离子化合物
[解析] 钠原子最外层只有1个电子,当它失去1个电子后形成的Na+具有最外层8个电子的稳定结构,氯原子最外层有7个电子,当它得到1个电子后形成的Cl-具有最外层8个电子的稳定结构,Na+和Cl-通过静电作用形成离子键,从而构成离子化合物NaCl。
[答案] B
2.下列元素的原子间反应形成的化学键最有可能是离子键的一组是( )
原子
a
b
c
d
e
f
g
M层电子数
1
2
3
4
5
6
7
A.a和c B.a和f
C.d和g D.c和g
[解析] 由原子a~g的M层电子数可知,M层即原子的最外层,元素a~g均为第三周期元素,a、b均为活泼的金属元素,f、g均为活泼的非金属元素,所以a和f形成的化学键为离子键。c为金属元素Al,c和g形成的化合物为AlCl3,属于共价化合物。
[答案] B
3.下列化合物中不存在离子键的是( )
A.MgBr2 B.H2SO4
C.(NH4)2SO4 D.NaH
[解析] A、C、D项都是离子化合物,其阴、阳离子即Br-与Mg2+、SO与NH、H-与Na+之间存在离子键。H2SO4是一种共价分子,不存在离子键。
[答案] B
7
4.下列叙述正确的是( )
A.元素周期表第一周期的元素之间可能形成离子键
B.元素周期表中第ⅠA族内的元素之间不可能形成离子键
C.离子化合物中一定含有阴离子和阳离子
D.离子化合物中一定含有金属元素
[解析] 元素周期表第一周期的元素是氢(非金属)和氦(稀有气体元素,性质特别稳定),它们之间不可能形成离子键;元素周期表中第ⅠA族内有非金属元素氢和活泼的碱金属元素,氢元素和活泼的碱金属元素之间可以形成离子键,如离子化合物NaH;离子化合物中一定含有阴离子和阳离子,但不一定含有金属元素,如NH4Cl是离子化合物,但不含金属元素。
[答案] C
5.氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应生成H2和NaOH。下列叙述中不正确的是( )
A.NaH的电子式为Na+[H]-
B.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C.微粒半径:H-Li+,C错误;NaH与H2O反应生成氢气和NaOH,在这个反应中只有氢元素的化合价发生了变化,NaH中H元素的化合价升高作还原剂,被氧化,水中H元素的化合价降低,被还原作氧化剂,D正确。
[答案] C
二、电子式的书写
6.下列电子式中正确的是( )
A.[Ca2+][]2-
B.Na+-
C.[]-Mg2+[]-
D.Na[]2-
[解析] 氧化钙的电子式为Ca2+[]2-,故A错误;氯化钠的电子式为Na+[]-,故B错误;溴化镁的电子式为[]-Mg2+[]-
7
,故C正确;氧化钠的电子式为:Na+[]2-Na+,故D错误。
[答案] C
7.下列有关电子式的叙述正确的是( )
A.H、He、Li的电子式分别为H·、·He·、·Li
B.氯原子的电子式为·,Cl-的电子式为
C.钠离子、镁离子、铝离子的电子式分别为Na+、Mg2+、Al3+
D.Na2O的电子式为Na+[]2-Na+,H2O的电子式为H+[]2-H+
[解析] A中锂原子的电子式应为Li·;B中Cl-的电子式应为[]-;D中H2O的电子式应为HH;金属阳离子的电子式与离子符号相同,C正确。
[答案] C
8.下列用电子式表示的化合物的形成过程正确的是( )
[解析] NaBr的电子式应写成Na+[]-,A项错误;用电子式表示CaF2的形成过程应写成
Ca―→[]-Ca2+[]-,B项错误;用电子式表示化合物的形成过程,应将“===”写成“―→”,D项错误。
[答案] C
[能力提升]
9.下列物质中不含离子键的是( )
①NH4HCO3 ②NH3 ③Na2SO4 ④H2O2
⑤Ba(OH)2 ⑥H2SO4
7
A.②④⑥ B.②④⑤
C.①③⑤ D.②③⑥
[解析] NH4HCO3含有离子键和共价键,①错误;NH3只含共价键, ②正确;Na2SO4 既含有离子键又含共价键,③错误;H2O2只含有共价键,④正确;Ba(OH)2 既含有离子键又含共价键,⑤错误;H2SO4只含共价键,⑥正确,故选A。
[答案] A
10.下列表示物质结构的化学用语正确的是( )
A.H、D、T表示同一种核素
B.MgCl2的形成过程
Mg―→[]-Mg2+[]-
C.Cl-的结构示意图:
D.NH4Cl的电子式:
[解析] H、D、T是同一种元素的三种核素,故A错误;氯离子是由氯原子得一个电子形成,核电荷数仍为17,故氯离子的结构示意图为,故C错误;氯化铵为离子化合物,氯离子的最外层电子数必须标出,氯化铵正确的电子式为,故D错误。
[答案] B
11.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
[解析]
7
离子键是使阴、阳离子结合成化合物的静电作用,要注意区别静电作用和静电引力,A项错误;金属与非金属原子之间不一定形成离子键,B项错误;由CaCl2的电子式:[]-Ca2+[]-可以看出,离子键存在于阴离子和阳离子之间,C项错误;含有离子键的化合物一定是离子化合物,D项正确。
[答案] D
12.X、Y、Z、W是原子序数依次增大的不同主族的短周期元素,X、Y的简单离子的核外电子数相同,Y的原子半径是短周期主族元素原子中最大的,Z原子最外层电子数是K层的3倍。下列说法正确的是( )
A.简单离子半径:Y>Z
B.X只能形成HXO3型的酸
C.气态氢化物的热稳定性:WZ,故C错误;元素Na与S、Cl分别形成Na2S、NaCl,都是离子化合物,故D正确。
[答案] D
13.下图所示是从元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素。
(1)若X单质为空气的主要成分之一,则W的原子结构示意图为________。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,则这三种酸的正盐的含氧酸根离子中,有两种电子数相等,这两种离子的离子符号分别为________、________。
(3)若Na与Y和Z的单质分别反应可以生成相对分子质量相同的两种化合物,其中Na与Y形成的化合物的电子式为________,所含化学键的类型为________。
[解析] (1)空气的主要成分是N2和O2。若X为O,则Y、Z为稀有气体元素。W没有相对应的元素,不符合题意。故X为N,W为Ar,Ar的原子结构示意图为。
(2)三元酸为H3PO4,即Z为P,Y为N,W为S,三种酸的正盐的含氧酸根离子中,PO
7
和SO的电子数相等。
(3)Na与O2和S分别反应生成Na2O2和Na2S,二者的相对分子质量相等,其中Na2O2中既含有离子键,又含有共价键。
[答案] (1) (2)PO SO
(3)Na+[]2-Na+ 离子键、共价键
14.X、Y、Z、W是短周期中的四种常见元素,其相关信息如表:
元素
相关信息
X
X最外层电子数是次外层电子数的3倍
Y
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积
Z
Z和Y同周期,Z的非金属性大于Y
W
W的一种核素的质量数为23,中子数为12
(1)Y位于元素周期表第________周期________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是__________________(填化学式)。
(2)Z的简单离子的电子式为________。
(3)W可以与X形成两种化合物,写出这两种化合物的电子式:________________、________________。
[解析] X最外层电子数是次外层电子数的3倍,则共有2个电子层,故X为O;Y单质是淡黄色固体,则Y为S;Z和Y同周期,Z的非金属性大于Y,则Z为Cl;W的一种核素的质量数为23,中子数为12,则其质子数为11,故W为Na。(1)S位于第三周期ⅥA族;非金属性越强,最高价氧化物对应的水化物的酸性越强。(2)Z的简单离子为Cl-。(3)Na与O可以形成Na2O和Na2O2。
[答案] (1)三 ⅥA HClO4 (2)[]-
(3)Na+[]2-Na+ Na+[]2-Na+
15.卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。CaO2和Na2O2在结构和性质上有很多相似的地方。请完成下列问题:
(1)CaO2属于________(填“离子化合物”或“共价化合物”),其电子式为________,其阴、阳离子个数比为________。
(2)CaO2与水反应的化学方程式为_________________________
_________________________________________________________,
生成1 mol单质气体,转移的电子数为________。
7
(3)CaO2与二氧化碳反应的化学方程式为___________________
_________________________________________________________,
该反应属于________。
A.置换反应 B.氧化还原反应 C.复分解反应
[解析] CaO2与Na2O2在结构和性质上相似,应为离子化合物,其电子式为Ca2+[]2-,既含离子键,又含非极性共价键。由电子式可推知其阴、阳离子个数比为1∶1。CaO2与水、二氧化碳的反应由Na2O2与水、二氧化碳的反应分析类比即可。
[答案] (1)离子化合物 Ca2+[]2- 1∶1
(2)2CaO2+2H2O===2Ca(OH)2+O2↑ 1.204×1024(或2NA)
(3)2CaO2+2CO2===2CaCO3+O2 B
7
相关文档
- 2020学年高中化学 第2章 化学键与2021-08-2414页
- 高中化学课件必修二《第一章 第三2021-08-2416页
- 离子键学案12021-08-246页
- 高中化学课时作业4离子键苏教版必2021-08-249页
- 2020版高中化学 第2章 第3节 离子2021-08-0614页
- 2019-2020学年高中化学课时作业6离2021-08-066页
- 2020版高中化学 专题1第二单元 微2021-08-0614页
- 2020届浙江学考一轮复习考点精讲通2021-07-087页
- 高中化学鲁科版选修3课后练习:2-3-12021-07-083页
- 2019-2020学年高中化学课时作业4离2021-07-087页