- 4.11 MB
- 2021-06-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
“皖南八校”2020届高三第二次联考
理科综合
2019.12
本卷命题范围:生物:必修①+必修②+选修①/③。
化学:必修1,必修2,选修4第一章~第三章,选修3和选修5(二选一)。
物理:必修①②,选修3-1,选修3-5,选考内容。
可能用到的相对原子质量:H-1 B-11 C-12 O-16 Na-23 P-31 S-32
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2019年诺贝尔生理学或医学奖揭晓:三名获奖科学家发现了“细胞如何感知和适应不断变化的氧气供应”,并确认了“能够调节基因活性以适应不同氧气水平的分子机制”。红细胞的主要工作就是输送氧气,关于人体红细胞的叙述错误的是
A.血浆中氧气浓度的变化会影响红细胞运输氧气的速率
B.缺铁会导致人体细胞无法合成血红蛋白而影响氧气运输
C.吞噬细胞清除衰老红细胞的过程与细胞间的信息交流有关
D.成熟红细胞只进行无氧呼吸,可在细胞质基质中产生 NADPH
2.图甲表示某动物卵原细胞中的一对同源染色体,图乙表示该卵原细胞形成的卵细胞中的一条染色体。若只考虑图中字母所表示的基因,下列分析正确的是
A.该卵原细胞形成的第一极体的基因型为aeD
B.甲中基因E与e的分离可发生在有丝分裂后期
C.形成乙的次级卵母细胞中不存在同源染色体,但可能存在等位基因
D.甲形成乙的过程中发生了基因重组和染色体结构变异
3.下列关于生物学实验的叙述,正确的是
①在“脂肪的鉴定”实验中,体积分数为50%的酒精溶液的作用是溶解组织中的脂肪
②在“观察紫色洋葱鳞片叶细胞质壁分离与复原”实验中,原生质层的形态和位置变化为因变量,该实验不存在对照
③在“用过氧化氢酶探究pH对酶活性的影响”实验中,过氧化氢分解速率最快的实验组的pH就是过氧化氢酶的最适pH
④小鼠吸人18O2,则在其尿液中可检测到H218O,呼出的CO2也可能含有18O
⑤在“光合色素的提取和分离”实验中,若层析分离结果显示某相邻两条色素带间距很小,说明此二者在层析液中的溶解度差异小
A.①③ B.④⑤ C.②④ D.③④
4.某种小鼠(XY型)的体色有黑色、黄色和白色,让黄色雌鼠与白色雄鼠杂交,获得F1,F1中雄鼠都表现为黄色,雌鼠都表现为黑色。让F1自由交配,F2中雌雄鼠的表现型及比例均为黑色:黄色:
·20·
白色=3:3:2。下列叙述错误的是
A.控制该种小鼠体色基因的遗传遵循自由组合定律
B.若亲本雄鼠与F1雌鼠杂交,子代雌鼠和雄鼠的毛色表现型不同
C.若F2中黄色小鼠自由交配,子代中黄色小鼠出现的概率为5/6
D.若F2中黑色小鼠自由交配,子代雄鼠毛色表现型及比例为4:4:1
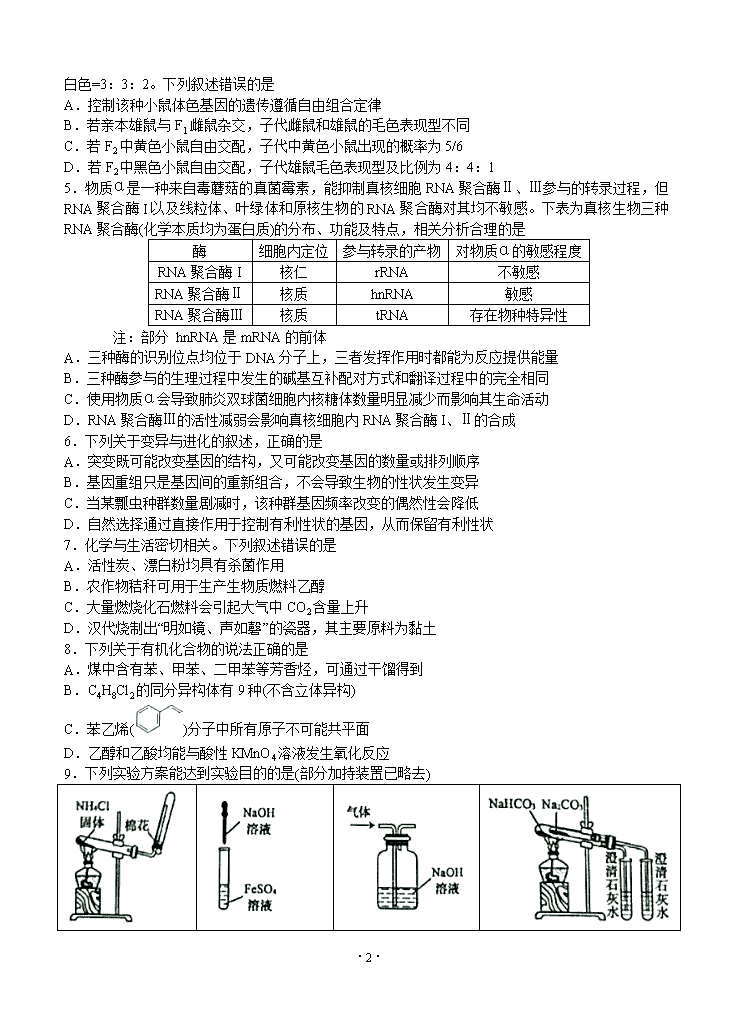
5.物质α是一种来自毒蘑菇的真菌霉素,能抑制真核细胞RNA聚合酶Ⅱ、Ⅲ参与的转录过程,但RNA聚合酶I以及线粒体、叶绿体和原核生物的RNA聚合酶对其均不敏感。下表为真核生物三种RNA聚合酶(化学本质均为蛋白质)的分布、功能及特点,相关分析合理的是
酶
细胞内定位
参与转录的产物
对物质α的敏感程度
RNA聚合酶I
核仁
rRNA
不敏感
RNA聚合酶Ⅱ
核质
hnRNA
敏感
RNA聚合酶Ⅲ
核质
tRNA
存在物种特异性
注:部分 hnRNA是mRNA的前体
A.三种酶的识别位点均位于DNA分子上,三者发挥作用时都能为反应提供能量
B.三种酶参与的生理过程中发生的碱基互补配对方式和翻译过程中的完全相同
C.使用物质α会导致肺炎双球菌细胞内核糖体数量明显减少而影响其生命活动
D.RNA聚合酶Ⅲ的活性减弱会影响真核细胞内RNA聚合酶I、Ⅱ的合成
6.下列关于变异与进化的叙述,正确的是
A.突变既可能改变基因的结构,又可能改变基因的数量或排列顺序
B.基因重组只是基因间的重新组合,不会导致生物的性状发生变异
C.当某瓢虫种群数量剧减时,该种群基因频率改变的偶然性会降低
D.自然选择通过直接作用于控制有利性状的基因,从而保留有利性状
7.化学与生活密切相关。下列叙述错误的是
A.活性炭、漂白粉均具有杀菌作用
B.农作物秸秆可用于生产生物质燃料乙醇
C.大量燃烧化石燃料会引起大气中CO2含量上升
D.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
8.下列关于有机化合物的说法正确的是
A.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏得到
B.C4H8Cl2的同分异构体有9种(不含立体异构)
C.苯乙烯()分子中所有原子不可能共平面
D.乙醇和乙酸均能与酸性KMnO4溶液发生氧化反应
9.下列实验方案能达到实验目的的是(部分加持装置已略去)
·20·
A.实验室制氨气
B.实验室制氢氧化亚铁
C.除去实验室所制乙烯中的少量SO2
D证明碳酸氢钠的热稳定性比碳酸钠弱
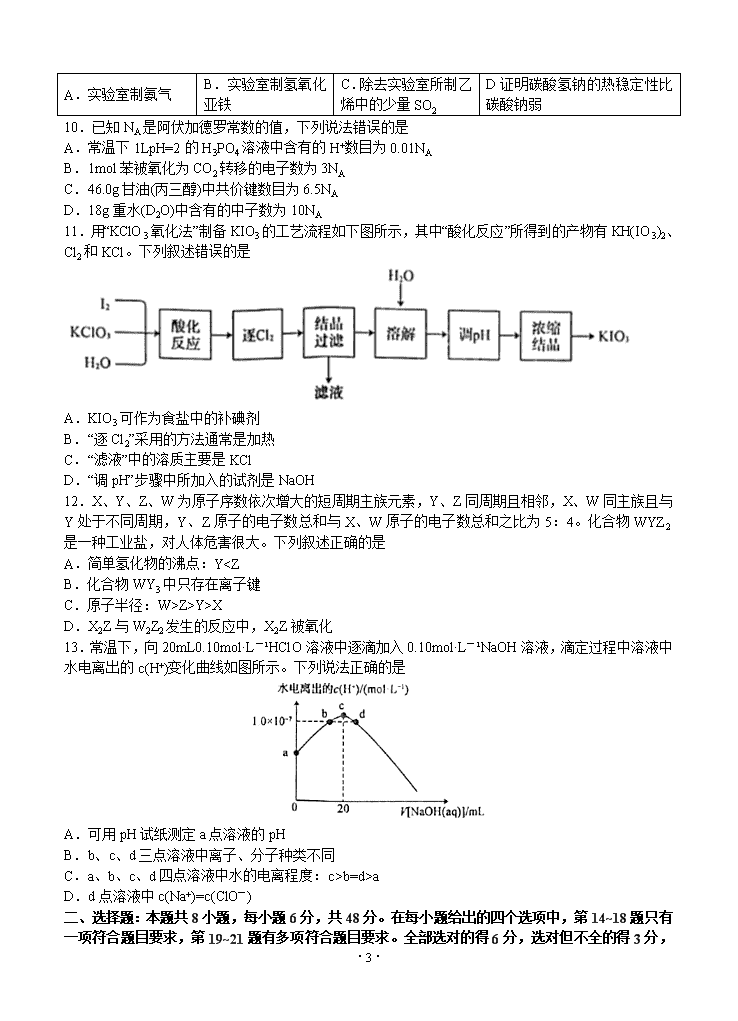
10.已知NA是阿伏加德罗常数的值,下列说法错误的是
A.常温下1LpH=2的H3PO4溶液中含有的H+数目为0.01NA
B.1mol苯被氧化为CO2转移的电子数为3NA
C.46.0g甘油(丙三醇)中共价键数目为6.5NA
D.18g重水(D2O)中含有的中子数为10NA
11.用“KClO3氧化法”制备KIO3的工艺流程如下图所示,其中“酸化反应”所得到的产物有KH(IO3)2、Cl2和KCl。下列叙述错误的是
A.KIO3可作为食盐中的补碘剂
B.“逐Cl2”采用的方法通常是加热
C.“滤液”中的溶质主要是KCl
D.“调pH”步骤中所加入的试剂是NaOH
12.X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是
A.简单氢化物的沸点:YZ>Y>X
D.X2Z与W2Z2发生的反应中,X2Z被氧化
13.常温下,向20mL0.10mol·L-1HClO溶液中逐滴加入0.10mol·L-1NaOH溶液,滴定过程中溶液中水电离出的c(H+)变化曲线如图所示。下列说法正确的是
A.可用pH试纸测定a点溶液的pH
B.b、c、d三点溶液中离子、分子种类不同
C.a、b、c、d四点溶液中水的电离程度:c>b=d>a
D.d点溶液中c(Na+)=c(ClO-)
二、选择题:本题共8小题,每小题6分,共48分。在每小题给出的四个选项中,第14~18题只有一项符合题目要求,第19~21题有多项符合题目要求。全部选对的得6分,选对但不全的得3分,
·20·
有选错的得0分
14.根据国家能源局规划,到2020年我国将实现核电5800千瓦投运,300千瓦在建目标,铀核裂变是获取核能的重要途径,在一次铀核裂变中,一个中子轰击U的核反应方程为:
n+U→Xe+Sr+mn,则m为
A.10 B.9 C.3 D.2
15.我国西电东送工程中,采用了1100KV特超高压直流输电技术其中有两个输电塔之间的输电线近似可看成是水平直导线且沿东西方向,两塔之间距离为L,某时刻输电电流为I,已知该地区地磁场方向与水平方向的夹角为30°,磁感应强度大小为B。则该时刻其中一根导线所受到地磁场的安培力的大小为
A.BIL B.BIL C.BIL D.0
16.一个质量为0.1kg的小球从20m高处落下,与地面碰撞后反弹,上升的最大高度为12.8m,小球从开始下落到上升到最高点所用时间为4s,重力加速度g=10m/s2,不计空气阻力,则小球对地面的平均作用力大小为
A.8N B.10N C.12N D.15N
17.如图所示,质量为m的物块放在固定粗糙斜面上的A点,由静止下滑到斜面底端所用的时间为t,若在物块放在A点的同时,给物块施加一个竖直向下、大小等于mg的压力(g为重力加速度),则物块由静止滑到斜面底端的时间为
A. B. C.t D.
18.一匀强电场的方向竖直向下t=0时刻,一带正电粒子以一定初速度水平射入该电场,电场力对粒子做功的功率为P,不计粒子重力,则P-t关系图像是
19.如图所示,某卫星在轨道1的A点经半椭圆轨道2变轨到轨道3上B点轨道3半径是轨道1半径的2倍,卫星在轨道1上运行时的周期为T,下列说法正确的是
·20·
A.卫星沿轨道2从A运动到B的过程中,速度在变小
B.卫星沿轨道2从A运动到B的过程中,机械能在变小
C.卫星在轨道3上运行的周期为2T
D.卫星从A点沿轨道2运动到B点所用时间为
20.如图所示,M、N为椭圆的两个焦点,在M、N两点分别放置电量均为q的正、负点电荷,椭圆的长轴为AB,短轴为CD,O是椭圆的中心,则下列说法正确的是
A.A、B两点电场强度和电势均不相同
B.C、D两点电场强度和电势均相同
C.将一个负电荷从A点沿椭圆移到B点,电场力做负功
D.椭圆内越靠近M点电势越高,电场强度越大,越靠近N点电势越低,电场强度越小
21.如图所示为甲、乙两个质点从同一位置同时开始做直线运动的位移-时间图像,甲的图线为抛物线,则下列说法正确的是
A.甲运动的初速度大小为5m/s
B.甲、乙相遇时,运动方向相反
C.甲、乙两质点间的距离先减小后增大
O.在甲、乙相遇前,甲的速度为2.5m/s时,甲乙相距最远
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分
22.(5分)某同学设计了一种测物块与斜面间的动摩擦因数的方法:在底边长为L、高为H的斜面体的底端附近A点安装一个光电门,让装有遮光片的物块从斜面上B点由静止释放。
·20·
(1)已知遮光条的宽度为d,与光电门相连的光电计时器,记录物块通过光电门时遮光片遮光时间为t,则物块通过光电门时的速度大小为v=___________;
(2)测得A、B问的距离为s,重力加速度为g,则物块在斜面体上运动的加速度大小为a=___________;物块与斜面体间的动摩擦因数μ=___________。
23.(10分)某同学在做“测定金属丝的电阻率”的实验时,进行了如下操作:
(1)先用螺旋测微器测量电阻丝的直径d如图甲所示,则金属丝的直径d=___________mm ;
(2)设计如图乙所示电路测金属丝的电阻,根据乙图将丙图中的实物图连接完整。
(3)闭合电键前,丙图中的滑动变阻器的滑片应移到最___________(填“左”或“右”)端,闭合电键后移动滑动变阻器,测得多组电压、电流的值,在坐标纸上作出U-I图像如图丁所示,则可求得电阻丝的R=___________Ω(保留2位有效数字)测得金属丝接入电路的长为L,则根据电阻定律可得到电阻丝的电阻率ρ=___________(用R、d、L表示)根据图乙电路测金属丝的电阻,测量结果将比真实值___________(选填“倜大”或“偏小”)
24.(12分)如图所示,甲、乙两个物块放在光滑的水平面上,用细线连接,轻弹簧压缩在两物块之间,
·20·
物块丙静止在光滑水平面上,与甲、乙在一条直线上.甲、乙、丙的质量分别为2m、m、m,使甲、乙一起以速度v0向右匀速运动,乙与丙碰撞后粘在一起,甲、乙、丙以共同速度一起向右运动过程中,连接甲、乙的细线断开,最后,甲的速度刚好为零,求:
(1)乙与丙碰撞过程中损失的机械能;
(2)弹簧被压缩时具有的弹性势能。
25.(20分)如图所示,在竖直直角坐标平面xOy区域I(0≤x≤L)和区域Ⅱ内分别存在匀强电场,区域I内电场强度大小为E,方向沿竖直y轴正方向,区域Ⅱ内电场强度大小方向未知,一质量为m、电荷量为q的带正电的小球从坐标原点O以某一初速度沿水平x轴正方向射入电场区域I,从P点进入电场区域Ⅱ,到达区域Ⅱ右边界的Q点时速度恰好为零,P点的坐标为(L,L).重力加速度为g,求:
(1)带电小球射入电场区域I时的初速度大小.
(2)若区域Ⅱ内电场方向水平,求小球从O到Q电场力做的功。
(3)若区域Ⅱ内场强取最小值,求此最小电场强度和Q点坐标。
26.(14分)锗是第四周期第ⅣA族元素,锗是重要的半导体材料,用于制造晶体管及各种电子装置。下图为以锗锌矿(含GeO2、ZnS及少量Fe2O3)为原料生产高纯度锗的工艺流程如下:
已知:GeO2可溶于强碱溶液,生成锗酸盐。GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)步骤①中提高碱浸效率的措施有______________________(写一种),NaOH溶液碱浸时发生反应的离子方程式为______________________。
(2)操作a的名称是___________,GeCl4的电子式为_______________。
(3)滤渣1中除含有ZnS外,还含有少量___________。滤渣2中除含有 CaGeO3外,还含有少量
·20·
___________。
(4)步骤⑤中加入浓盐酸,发生反应的化学方程式为______________________。不用稀盐酸的原因是______________________。
(5)写出一种证明步骤⑧反应完全的操作方法:______________________。
27.(15分)硫代硫酸钠(Na2S2O3)可以除去自来水中的氯气,在水产养殖上被广泛应用。用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O的实验流程如下:
回答下列问题:
(1)试剂X是一种二元化合物的钡盐,它与Na2SO4反应的化学方程式为___________________。
(2)用热水溶解并趁热过滤的目的是______________________。
(3)利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3,所需仪器如下图:
①从左到右连接各仪器,导管的接口顺序为:___________接e、f接___________、___________接___________、___________接d。
②E中发生反应的离子方程式为______________________。
③装置B的作用是______________________。
(4)操作1包括蒸发浓缩、______________________、___________、洗涤、干燥
(5)为测定产品Na2S2O3·5H2O的纯度,准确称取12.4gNa2S2O3·5H2O产品,配制成100mL溶液,取25.00mL溶液,以淀粉溶液作指示剂,用0.2500mol·L-1碘的标准溶液滴定,发生反应2S2O32-+I2==== S4O62-+2I-,消耗碘的标准溶液20.00mL,则该产品的纯度为___________。
28.(14分)环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(C—N==O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。
相关化学键的键能如下表所示:
化学键
Cl—Cl
N≡O(NO气体)
Cl—N
N==O
键能/(kJ·mol-1)
243
630
200
607
(2)为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO2CO2+N2,平衡时CO的体积分数与温度(T1
相关文档
- 数学卷·2018届山西省晋城市陵川一2021-06-1018页
- 数学卷·2018届山东省枣庄八中北校2021-06-1012页
- 浙江省2013届高三高考模拟冲刺数学2021-06-109页
- 2006年四川省高考数学试卷(理科)【附2021-06-109页
- 文数试卷--华大新高考联盟2020届高2021-06-104页
- 数学卷·2018届河北省保定三中高二2021-06-1023页
- 数学卷·2018届福建省三明一中高二2021-06-1024页
- 辽宁省瓦房店市第三高级中学2019届2021-06-105页
- 河北省石家庄市辛集中学2019-20202021-06-109页
- 数学卷·2018届福建省福州市八县(市2021-06-1019页